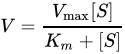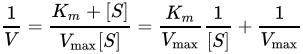酵素-6(ほ)
|
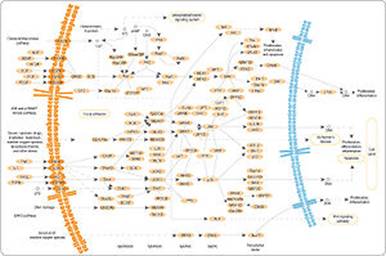
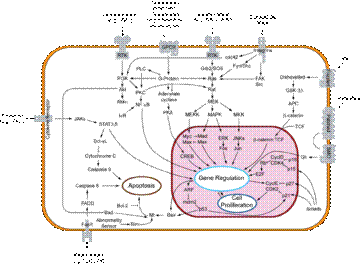
lま 分裂促進因子活性化タンパク質キナーゼ
分裂促進因子活性化タンパク質キナーゼ(ぶんれつそくしんいんしかっせいかタンパクしつキナーゼ、英: Mitogen-activated Protein Kinase、MAPK、EC 2.7.11.24)とはセリン/スレオニンキナーゼの一つであり、何らかの刺激(酸化ストレス、サイトカインなど)を受けて活性化される。全身の細胞に広く発現しており、様々な細胞の機能発現において重要な働きをしている。単にMAP(マップ)キナーゼと略して呼ばれることが多い。 細胞外からの刺激が入ると低分子量Gタンパク質であるRasが活性化され、さらにその下流に続くシグナルカスケードの活性化が引き起こされる。また、MAPKホスファターゼ(MAPK Phosphatase: MKP)による脱リン酸化がMAPKを不活性化し、この機構に対して抑制的に働いている。 狭義には細胞外シグナル調節キナーゼ(英: Extracellular Signal-regulated Kinase、ERK)1/2のみを指すが、広義にはこれに加えてc-Jun N末端キナーゼ(英: c-jun N-terminal kinase、JNK)、p38 MAPK、ERK5およびERK7等の分子をも含み、MAPKファミリーとも呼ばれる。
ERK1/2(古典的MAPK)ERK1/2はMAPKファミリーの中でも最初に同定されたものであり、古典的MAPKとも称される。ERK1/2は分子量が44kDaのERK1と42kDaのERK2から成り、これらのタンパク質のアミノ酸配列は互いに85%の相同性がある。 ERK1/2の活性化は以下のような機序で生じる。上皮増殖因子受容体(英: Epidermal Growth Factor Receptor、EGFR)等のチロシンキナーゼ関連型受容体にリガンドが結合すると受容体細胞内ドメインのリン酸化が生じる。Grb2等のSH2ドメインを含むアダプタータンパク質が受容体のリン酸化チロシンに結合すると、Grb2はSH3ドメインを介してSosと結合し、Sosを活性化させる[1]。活性化したSosはRasのGDP-GTP交換反応によりRasを活性化させる[2]。以下、RasはMAPキナーゼカスケードへとシグナルを伝えていくが、RasはMAPキナーゼキナーゼキナーゼ (MAPKKK) であるRafを、RafはMAPキナーゼキナーゼであるMAPK/ERK kinase (MEK) を活性化し、このMEKによりERKの活性化が引き起こされる。ERKの活性化にはThr183及びTyr185が重要な働きをしている。通常ERK1/2は細胞質に優位に存在するが、活性化されることにより核内へ移行して転写因子と相互作用することにより転写の制御を行っている。この経路はPD98059、U0126等の試薬によって阻害される。 新規MAPKJNKJNKはc-JunのSer63とSer73をリン酸化する活性を持つキナーゼとして同定された。JNKは放射線やリポ多糖 (LPS)、IL-1、浸透圧及び熱ショックなどのストレスにより活性化し、ストレス応答性MAPK (Stress-activated Protein Kinase、SAPK) とも呼ばれる。 JNK遺伝子にはJNK1-3が存在する。JNK1,2は全身の細胞に広く分布しているが、JNK3は主に神経系及び精巣において見られる[3]。 JNK1はアポトーシスや神経変性、細胞の分化・増殖、炎症性サイトカインの産生などの過程に関与している[4] 。JNKは様々な細胞内タンパク質のリン酸化を行い、それらの機能修飾をしている。SP600125によって阻害される。 p38 MAPK詳細は「p38分裂促進因子活性化タンパク質キナーゼ」を参照 p38MAPKはサイトカインによる刺激や紫外線照射、熱・浸透圧ストレスなどによって活性化されるプロテインキナーゼであり、Thr180/Tyr182のリン酸化がp38MAPKの活性化において重要な働きをしている。p38MAPKの遺伝子にはp38MAPKα,β,γ及びδの4種類が知られている。p38MAPKの上流にはMKK3やMKK6が存在する。SB203580により阻害される。 脚注1. ^ Schulze WX, Deng L and Mann M (2005). “Phosphotyrosine interactome of the ErbB-receptor kinase family”. Mol. Syst. Biol. 125.0008. doi:10.1038/msb4100012. PMC 1681463. PMID 16729043. 2. ^ Zarich N, Oliva JL, Martínez N, Jorge R, Ballester A, Gutiérrez-Eisman S, García-Vargas S, Rojas JM (2006). “Grb2 is a negative modulator of the intrinsic Ras-GEF activity of hSos1”. Mol. Biol. Cell. 17 (8): 3591-3597. doi:10.1091/mbc.E05-12-1104. PMC 1525251. PMID 16760435. 3. ^ Waetzig V and Herdegen T (2005). “Context-specific inhibition of JNKs: overcoming the dilemma of protection and damage”. Trends Pharmacol. Sci. 26 (9): 455-461. doi:10.1016/j.tips.2005.07.006. PMID 16054242. 4. ^ Oltmanns U, Issa R, Sukkar MB, John M, Chung KF (2003). “Role of c-jun N-terminal kinase in the induced release of GM-CSF, RANTES and IL-8 from human airway smooth muscle cells”. Br. J. Pharmacol. 139 (6): 1228-1234. doi:10.1038/sj.bjp.0705345. PMC 1573939. PMID 12871843. 出典
外部リンク
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
マルトオリゴシルトレハロースシンターゼ
マルトオリゴシルトレハロースシンターゼ(Maltooligosyl trehalose synthase、マルトオリゴシルトレハロース合成酵素、MTSase)は、トレハロース生合成経路の第一段階で働く酵素で、マルトオリゴ糖(重合度3以上のα-1,4グルカン)の還元末端のα-1,4結合を主として分子内転移によりα,α-1,1結合に変化させる反応を触媒する酵素である[1]。 系統名は、(1→4)-α-D-glucan 1-α-D-glucosylmutase[2]。EC 5.4.99.15。GH13ファミリー。 概要 重合度3以上のα-1,4グルカンに作用し、還元性末端のα-1,4グルコシド結合を分子内転移によりα,α-1,1結合に変換し、同じ重合度のグリコシルトレハロースを生成する。この反応は可逆的で、分子間転異反応はない。 このグリコシルトレハロースにマルトオリゴシルトレハローストレハロヒドラーゼを作用させることで、効率良くトレハロースを生成することができる。 Arthrobacter属、Brevibacterium属、Rizobium属、Sulfolobus属などの菌体内で、マルトオリゴシルトレハローストレハロヒドラーゼとともにみいだされている[3]。
出典 ^ トレハロース合成酵素の精密化結晶構造と触媒機構 ^ (1-4)-α-D-グルカン-1-α-D-グルコシルムターゼ参照 ^ 『澱粉の科学と技術』 ISBN 978-4990528706
関連項目 酵素 トレハロース マルトオリゴシルトレハローストレハロヒドラーゼ 外部リン トレハロース生成に関与する新規な酵素 新規酵素による澱粉からのトレハロース製造 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
マンデル酸ラセマーゼ Mandelate racemase oktamer, Pseudomonas putida. マンデル酸ラセマーゼ(Mandelate racemase、EC 5.1.2.2)は、エノール中間体を経由してマンデル酸のエナンチオマー間の相互変換を触媒する酵素である。 ムコン酸シクロイソメラーゼ、エノラーゼとともにエノラーゼスーパーファミリーに分類される。 外部リンク mandelate racemase - MeSH、米国国立医学図書館、生命科学用語シソーラス (英語サイト) EC 5.1.2.2 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
む ムターゼ ムターゼ(英:Mutase)とは、同一分子内である官能基をとある場所から別の場所に移動させることを触媒する酵素のことである[1]。 概要 ムターゼによる分子内転移では、基質の構造は変わるが原子組成は変化しない[1]。 この酵素の例として、赤血球中に見られるビスホスホグリセリン酸ムターゼや3-ホスホグリセリン酸を2-ホスホグリセリン酸に変化させて解糖系で働くホスホグリセリン酸ムターゼなどがある[2]。 脚注 [ヘルプ] ^ a b Conn, Stumpf p.120 ^ Conn, Stumpf p.p.308-309 参考文献 Conn, E.E.,Stumpf, P.K.,et al. 『コーン・スタンプ生化学』 田宮信雄、八木達彦訳、東京化学同人、1988年3月11日(原著1965年4月1日)、第5版。ISBN 4-8079-0299-7。 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
め β-ラクタマーゼβ-ラクタマーゼ(ベータラクタマーゼ、β-lactamase)とはβ‐ラクタム系抗生物質を加水分解する酵素である。ペニシリン/セファロスポリンアミド-β-ラクタムヒドロラーゼ (penicillin/cepharosporin amido-β-lactam hydrolase)とも呼ばれる。EC3.5.2.6に分類される酵素である。 幾つかの種類のグラム陰性菌がβ-ラクタマーゼを産生することでβ-ラクタムに対して耐性を示すことが知られている。なお、β-ラクタム耐性はβ-ラクタマーゼのみが原因ではなくMRSAのようにペニシリン結合タンパク質の基質特異性が変化しても現れる。 現在β-ラクタマーゼは基質特異性の違いにより · ペニシリナーゼ (クラスA β-ラクタマーゼ) · メタロ-β-ラクタマーゼ (クラスB β-ラクタマーゼ、亜鉛-β-ラクタマーゼ、カルバペネマーゼ) · セファロスポリナーゼ (クラスC β-ラクタマーゼ) · オキサシリナーゼ (クラスD β-ラクタマーゼ) これら4種のβ-ラクタマーゼのうち、クラスB β-ラクタマーゼは活性中心に亜鉛を持つが、他はセリン残基を持つ。ペニシリナーゼはペニシリン系抗生物質と第二世代セファロスポリンを分解するのに対して、セファロスポリナーゼは主にセファロスポリンを分解する。オキサシリナーゼはオキサシリンをも分解するペニシリナーゼであり、メタロ-β-ラクタマーゼはカルバペネム系抗生物質を分解する点に特徴がある。 β-ラクタマーゼの遺伝子は、細菌の染色体上あるいはプラスミド上に存在する。特に伝達性薬剤耐性プラスミド (drug resistance plasmid)に存在するβ-ラクタマーゼ遺伝子は菌種特異性も少なく多剤耐性菌の発生にも関与していると考えられる。 脚注1. ^ β-ラクタム耐性菌とその検出方法、関東化学 2. ^ Bush, K. et. al. A functional classification scheme for β-lactamases and its correlation with molecular structure, Antimicrob Agents Chemother., 39, 1211-1233, 1995. 3. ^ Ambler, R. P., The structure of β-lactameses, Philos Trans R Society Lond (Biol), 289, 321-331, 1980. 4. ^ 石井良和、基質特異性拡張型β-ラクタマーゼ産生大腸菌、クレブシエラ、臨床と微生物、26、121-125, 1999. 関連項目· クラブラン酸 · 薬剤耐性 · ペニシリン · セファロスポリン 出典· β-ラクタマーゼ『生物学辞典』第4版、岩波書店。 · β-ラクタマーゼについて 日本ベクトン・ディッキンソン株式会社 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
メチルクロトニルCoAカルボキシラーゼ
メチルクロトニルCoAカルボキシラーゼ(Methylcrotonyl-CoA carboxylase、MCC)は、ミトコンドリアに存在するビオチン要求性の酵素である。MCCは、炭酸水素塩を用いてロイシン生合成の第4段階でのカルボキシル基の隣接炭素原子のカルボキシル化を触媒する[1]。 機能分枝鎖アミノ酸の分解の際、MCCはロイシンをアセチルCoAとアセト酢酸にまで分解する反応の一段階に関わる[2]。MCCは、3-メチルクロトニルCoAの3-メチルグルタコニルCoAへのカルボキシル化の作用を触媒する。3-メチルグルタコニルCoAはその後水和され、3-ヒドロキシ-3-メチルグルタリルCoAとなり、アセト酢酸とアセチルCoAの2分子に分解される。 MCCをコードする遺伝子の部位突然変異または欠失突然変異は、代謝の先天異常であるMCC欠損症を引き起こし、嘔吐、代謝アシドーシス、血漿中グルコース濃度の低下、血漿中カルニチン濃度の低下等の症状を伴う[3]。 機構ATPの付加により炭酸水素塩が活性化し、反応性が高まる。炭酸水素塩が活性化すると、MCCのビオチン結合部位が求核剤として働き、酵素の結合したカルボキシビオチンを形成する。MCCのカルボキシビオチン結合部位は続いてさらに求核剤として基質にカルボキシル基を移し、3-メチルクロトニルCoAを3-メチルグルタコニルCoAに変換する[2]。 制御MCCは小分子、食物、ホルモン因子等による制御を受けない[3]。 出典
外部リンク
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
メチルマロニルCoAエピメラーゼ methylmalonyl CoA epimerase Ribbon diagram of methylmalonyl-CoA epimerase from Propionibacterium shermanii. From PDB 1JC5. 識別子 略号 MCEE Entrez 84693 HUGO 16732 OMIM 608419 RefSeq NM_028626 UniProt Q96PE7 他のデータ EC番号 (KEGG) 5.1.99.1 遺伝子座 Chr. 2 p13.3 メチルマロニルCoAエピメラーゼ(英:Methylmalonyl CoA epimerase)は、(S)-メチルマロニルCoAを(R)-メチルマロニルCoAに変換する酵素である。 外部リンク methylmalonyl-CoA epimerase - MeSH、米国国立医学図書館、生命科学用語シソーラス (英語サイト) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
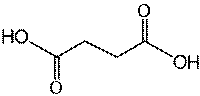
メチルマロニルCoAムターゼ
メチルマロニルCoAムターゼ(英: Methylmalonyl Coenzyme A mutase)は、メチルマロニルCoAをスクシニルCoAへの異性化を触媒する酵素であり、主要な代謝経路に含まれている。これが機能するためには、ビタミンB12誘導体補因子であるアデノシルコバラミンが必要である。 機能メチルマロニルCoAムターゼの基質であるイソロイシン、バリン、スレオニン、メチオニン、チミン、コレステロールや奇数鎖脂肪酸の代謝と消化により形作られるプロピオニルCoAがメチルマロニルCoAの主な原料である。この酵素の産生物であるスクシニルCoAは、クエン酸回路の主要な分子である。MCMはミトコンドリア内に所在し、メチオニン、スレオニン、チミン、奇数鎖脂肪酸と同様に分岐鎖アミノ酸であるイソロイシンやバリンを含む多数の物質も同様にミトコンドリア内に存在し、これらの物質はメチルマロン酸セミアルデヒド(MMISA)やプロピオニルCoAを経て普通の化合物であるメチルマロニルCoAに代謝される。 遺伝子
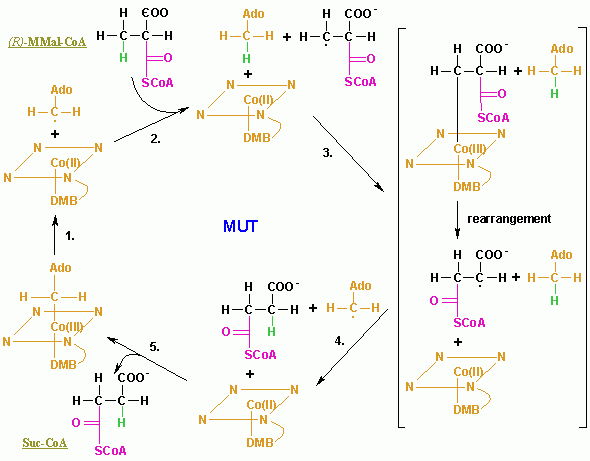
ヒトにおいてこの酵素の遺伝子はMUTとして知られている[5]。 病理学この酵素の欠乏は、メチルマロン酸血症の原因である代謝の遺伝病であるメチルマロニルCoAムターゼ欠乏症によって起こる。 メカニズムMUTの反応メカニズムは、アデノシルコバラミンのC-Co(III)結合の均一開裂で始まり、CとCoの原子とも電子を受け取り、電子対結合の開裂を形成する。Coイオンは、Co(III)とCo(II)の間の酸化状態を変動している。この2つの状況は分光測色法で判別が可能であり、Co(III)は赤色で反磁性(不対電子なし)でCo(II)は黄色で常磁性(不対電子あり)である。それゆえ、触媒反応でのビタミンB12の役割は、可逆の自由ラジカルを生成することである。C-Co(III)結合が元々弱く(解離エネルギー=109 kJ/mol)、酵素の立体的相互作用により結合力がさらに弱くなっているためC-Co(III)結合はこのメカニズムに大変適している。均一開裂反応は生化学では普通ではなく、ほとんどの生化学的な結合の開裂反応は異種開裂(開裂反応を形成する電子対は分離した原子のひとつにより十分に獲得できる。)を経て起こる。
脚注
参考
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
メテニルテトラヒドロ葉酸シクロヒドロラーゼ メテニルテトラヒドロ葉酸シクロヒドロラーゼ
メテニルテトラヒドロ葉酸シクロヒドロラーゼ(英:Methenyltetrahydrofolate cyclohydrolase )は、次の化学反応を触媒する酵素(EC 3.5.4.9)である。 5,10-メテニルテトラヒドロ葉酸+H2O ⇌ {\displaystyle \rightleftharpoons } 10-ホルミルテトラヒドロ葉酸 この酵素の2つの基質は、5,10-メテニルテトラヒドロ葉酸とH2Oであり、10-ホルミルテトラヒドロ葉酸を生成する。この酵素は、加水分解酵素に属している。 テトラヒドロ葉酸(THF)による代謝とビタミンB12によるTHFの再生産、de:Folsäure=葉酸、DHF=ジヒドロ葉酸、THF=テトラヒドロ葉酸、Vit.B12=ビタミンB12、Methyl-Vit.B12=メチルコバラミン、Methionin=メチオニン、Methionin Syntase=5-メチルテトラヒドロ葉酸-ホモシステインメチルトランスフェラーゼ、Homocystein=ホモシステイン、N5-Methyl-THF=5-メチルテトラヒドロ葉酸、N5,N10-Methylene-THF=5,10-メチレンテトラヒドロ葉酸、N10-Formyl-THF=10-ホルミルテトラヒドロ葉酸、dUMP=デオキシウリジン一リン酸、NADPH、DNA 参考文献 Rabinowitz JC and Pricer WE (1956). “The enzymatic synthesis of N10-formyltetrahydrofolic acid and its role in ATP formation during formiminoglycine degradation”. J. Am. Chem. Soc. 78: 4176–4178. doi:10.1021/ja01597a094. Tabor H and Wyngarden L (1959). “The enzymatic formation of formiminotetrahydrofolic acid, 5,10-methenyltetrahydrofolic acid, and 10-formyltetrahydrofolic acid in the metabolism of formiminoglutamic acid”. J. Biol. Chem. 234: 1830–1849. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
ゆ ユニット (酵素活性)
1分につき1マイクロモルの基質の化学反応を促進する酵素活性 テンプレートを表示 ユニット (unit) とは、医薬・臨床化学分野で用いられる酵素活性(触媒活性)の単位である。英語では enzyme unit、ドイツ語では Enzymeinheit で、そのまま訳せば「酵素単位」であるが、日本語では「ユニット」という単位名称で呼ばれる。 1ユニットは、至適条件下(温度30℃で、最も化学反応が進む酸性度)で毎分1マイクロモル(µmol)の基質を変化されることができる酵素量(1マイクロモル毎分)と定義されている。この単位は、1964年に国際生化学連合(現 国際生化学・分子生物学連合)が採択したものである。なお、この際の定義文中では「国際単位」(international unit)という名称が用いられているが、ビタミンなどの生物学的効果を示す国際単位(IU)や、国際単位系(SI)とは無関係である。 時間の単位「分」がSIにおいて「併用単位」にすぎないことから、1999年に1モル毎秒に相当するカタール(記号:kat)がSIに導入され[1][2]、ユニットはカタールに置き換えることが推奨されている。ユニットとカタールの換算は以下のようになる。 1 U = (1/60) µkat(マイクロカタール) = 約 16.667 nkat(ナノカタール) 1 kat = 60×106 U 出典 ^ 国際単位系(SI) 国際文書第8版(2006)、日本語版、(独)産業技術総合研究所 計量標準総合センター訳・監修、付録1,p.80、第21回 CGPM, 1999 年、「酵素活性の表現のための SI 組立単位,モル毎秒の固有の名称,カタール」 ^ 国際単位系(SI) 国際文書第8版(2006)、日本語版、(独)産業技術総合研究所 計量標準総合センター訳・監修、p.29、「表3 固有の名称と記号で表される一貫性のあるSI組立単位」中、酵素活性 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
ら インウィーバー=バークプロット生化学において、ラインウィーバー=バークプロット(英: Lineweaver–Burk plot)は、酵素反応速度論のラインウィーバー=バークの式のグラフ表示である。1934年にハンス・ラインウィーバーとディーン・バークによって記述された[1]。二重逆数プロットとも呼ばれる。 導出ラインウィーバー=バークプロットは、ミカエリス・メンテン式
の解析に有用なグラフ的手法である。 両辺の逆数を取ると、
となる。上式においてVは反応速度、Kmはミカエリス・メンテン定数、Vmaxは最大反応速度、[S] は基質濃度である。 使用強力な計算機や非線型回帰ソフトウェアが広く利用可能になる前、ラインウィーバー=バークプロットはKmやVmaxといった酵素反応速度論における重要な項を決定するために広く使われていた。グラフのy切片はVmaxの逆数と等しく、グラフのx切片は−1/Kmを表わす。また、様々な酵素阻害の形式を視覚的な印象として素早く与える。 この両逆数プロットはデータの誤差構造を歪めるため、酵素反応速度論のパラメータを決定する方法として信頼できない。反応速度に関するデータを描写するためには今でも使用されているものの[2]、非線型回帰あるいはヘインズ=ウルフプロットあるいはイーディー=ホフステー図といったミカエリス・メンテン式の代替となる線型形式がパラメータの計算のために一般的に使われている[3]。 酵素阻害の種類を決定するために使用すると、ラインウィーバー=バークプロットは競合、非競合、不競合阻害剤を区別することができる。競合阻害剤は阻害を受けていない酵素と同じy切片を持つが(競合阻害剤はVmaxに影響を与えないため、Vmaxの逆数も変化しない)、2組のデータ間で傾きとx切片に違いがある。非競合阻害剤は阻害を受けていない酵素と同じx-切片を与えるが(Kmが影響を受けない)、傾きとy切片が異なる。不競合阻害剤はy軸とx軸両方の切片に違いが出る。 問題点ラインウィーバー=バークプロットは古い教科書では古典的に用いられているが、間違いが生まれやすい。y軸が反応速度の逆数を取るため、測定における小さな誤差が増幅される。また、プロット上の多くの点がy軸の右側に遠く離れた位置にあるため(溶解性に限度があるため [S] が大きな値を取れず、ゆえに1/[S] が小さな値を取れない)、x切片およびy切片を得るために大きな外挿が要求される[4]。 脚注1. ^ Lineweaver, H and Burk, D. (1934). “The Determination of Enzyme Dissociation Constants”. J. Am. Chem. Soc. 56 (3): 658–666. doi:10.1021/ja01318a036. 2. ^ Hayakawa, K.; Guo, L.; Terentyeva, E.A.; Li, X.K.; Kimura, H.; Hirano, M.; Yoshikawa, K.; Nagamine, T. et al. (2006). “Determination of specific activities and kinetic constants of biotinidase and lipoamidase in LEW rat and Lactobacillus casei (Shirota)”. J Chromatogr B Analyt Technol Biomed Life Sci 844 (2): 240–50. doi:10.1016/j.jchromb.2006.07.006. PMID 16876490. 3. ^ Greco, W. R. and Hakala, M. T., (1979). “Evaluation of methods for estimating the dissociation constant of tight binding enzyme inhibitors” (PDF). J. Biol. Chem. 254 (23): 12104–12109. PMID 500698. 4. ^ Dowd, John E., and Douglas S. Riggs (1965). “A comparison of estimates of Michaelis-Menten kinetic constants from various linear transformations”. J. Biol. Chem. 240 (2): 863-869. PMID 14275146. 関連項目外部リンク
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
ラクトースシンターゼ ラクトースシンターゼ(英:Lactose synthase、EC 2.4.1.22)は、グルコースとUDP-ガラクトースからラクトースを合成する酵素である。ラクトースシンターゼは、N-アセチルラクトサミンシンターゼとα-ラクトアルブミンで構成されている。 UDP-ガラクトース + D-グルコース → ラクトース + UDP 外部リンク MeSH Lactose+synthase 炭水化物代謝:フルクトースとガラクトースの代謝酵素 フルクトース 代謝 フルクトキナーゼ(ケトヘキソキナーゼ) - B型アルドラーゼ(フルクトース-1-リン酸アルドラーゼ) ガラクトース/ラクトース 代謝 ガラクトキナーゼ - ガラクトース-1-リン酸ウリジリルトランスフェラーゼ - UDP-ガラクトース-4-エピメラーゼ - ラクトースシンターゼ - ラクターゼ - アルドースレダクターゼ |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
ラスブリカーゼラスブリカーゼ(Rasburicase)とは、尿酸を酸化して5-ヒドロキシイソ尿酸に代謝するための酵素、つまり、尿酸オキシダーゼである。尿酸は、分子状の酸素と水の存在する環境において、ラスブリカーゼによって5-ヒドロキシイソ尿酸と過酸化水素に変換される。その後、5-ヒドロキシイソ尿酸は自発的にアラントインと二酸化炭素とに分解する。こうして産生するアラントインは尿酸と比べて水溶性が高く、腎臓から容易に排泄される。 解説様々な生物(バクテリアも哺乳類も、さらにヒト上科を除くサルも)尿酸オキシダーゼの活性があるため尿酸の分解が可能である。しかし、ヒト上科では尿酸オキシダーゼが発現していないため、尿酸を分解できない [1] 。 尿酸は抗酸化物質である一方で、水への溶解度が低いために、時として生体内で結晶化して(針状晶を作って)、痛風の原因ともなる [1] 。 そこで血中の尿酸(20℃で水100 mlへは、0.006 g溶ける)を、より水溶性の高いアラントイン(25℃で水100 mlへは、0.057 g溶ける)に変換することで、痛風などが起きないようにするためにラスブリカーゼが投与されることがある。具体的には、腫瘍崩壊症候群のうち、主にガンの化学療法などが原因で腫瘍細胞が次々と死滅すると、細胞が持っている核酸が次々と遊離してくるわけだが、この核酸を代謝した時に、ヒト上科では尿酸オキシダーゼを欠くためにプリン塩基は尿酸にまでしか代謝できず、結果として大量の尿酸が溜まることがある。このようなことが起こるであろうと予測される時にラスブリカーゼが投与される場合がある [2] 。 2015年現在、基本的にラスブリカーゼは、この腫瘍崩壊症候群に対して使用するのが一般的である [3] 。 また、酷いリウマチなどをはじめとして、何らかの理由で大量の細胞が死んで、結果遊離してきた核酸を代謝したことで尿酸が溜まった状態の改善のために使用されることもある [4] 。 いずれにしても、ラスブリカーゼを投与した場合、尿酸は5-ヒドロキシイソ尿酸に変換され、その後自動的にアラントインが生成して、アラントインは腎臓から排泄されてゆく。 製法・構造・使用法ラスブリカーゼはアスペルギルス・フラバスのDNAのうち、尿酸オキシダーゼをコードしている部分を取り出し、それを出芽酵母に組み込むという方法で生産されている。こうして作られたラスブリカーゼも、一般的な尿酸オキシダーゼと同じく4つのサブユニットから成る4量体のタンパク質である。どのサブユニットも301個のアミノ酸からできており、組成式はC1523H2383N417O462S7で、分子量は約3万4151 (Da)である。これ4量体を形成しているので、ラスブリカーゼ全体では約13万6604 (Da)ほどである [注釈 1] 。 なお、薬剤として使用されるラスブリカーゼは、無菌状態に精製されており、かつ、凍結乾燥されて白い粉状にされてある。これを専用の溶解液に溶かして静脈へ点滴して用いる。以上のような製造法を取っていることもあり、ラスブリカーゼは比較的高価な薬剤として知られている。 副作用頻度は不明ながら、ラスブリカーゼを投与したことのよって起こる重大な副作用としてアナフィラキシーショックが起こる場合がある。この他、上記で述べたようにラスブリカーゼが尿酸を分解すると過酸化水素が生ずるため、これがヘモグロビン中の鉄を2価から3価に酸化し、メトヘモグロビン血症を起こすこともある。場合によっては溶血が起こることもある。特にグルコース-6-リン酸脱水素酵素欠損症の者の赤血球は過酸化水素による打撃を受けやすく、メトヘモグロビン血症や溶血性貧血が起こりやすい [1] 。 静脈内投与してしまったラスブリカーゼを回収したり、不活化して過酸化水素の発生を止める方法は確立していない。したがって、ラスブリカーゼを投与する前にグリコース-6-リン酸脱水酵素欠損症でないことを確認することが推奨されている [1] 。 注釈出典
参考文献
関連項目<img src="//ja.wikipedia.org/wiki/Special:CentralAutoLogin/start?type=1x1" alt="" title="" width="1" height="1" style="border: none; position: absolute;" /> 「https://ja.wikipedia.org/w/index.php?title=ラスブリカーゼ&oldid=56500008」から取得 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
り リガーゼリガーゼ(ligase)とはEC番号6群に属する酵素であり、ATPなど高エネルギー化合物の加水分解に共役して触媒作用を発現する特徴を持つ[1][2]。英語の発音に従ってライゲースと表記される場合もある[3]。リガーゼは別名としてシンテターゼ(シンセテース[3])と呼ばれる。日本語ではリガーゼを指して合成酵素と呼ぶことがあるが、合成酵素といった場合はEC6群のシンテターゼの他にEC4群のシンターゼを含むので留意が必要である。シンテターゼはATPなどの高エネルギー化合物分解と共役しているのに対して、シンターゼ(シンセース[3])はリアーゼ(ライエース[3])の一種であり高エネルギー化合物分解の共役は不要である。[4] 概要リガーゼには生合成経路上で重要な酵素が多く、代表的な酵素としては
などが挙げられる。 リガーゼの基質となる高エネルギー化合物はATPがほとんどであるが、GTPやNADなどもある。リガーゼはこれらの高エネルギー化合物と他の基質とがアデニル化,リン酸化,またはピロリン酸化された活性中間体を経由するとともに、加水分解により発生する自由エネルギー変化を駆動力にして触媒反応が生成側に進行する。 シンテターゼリガーゼの常用命名法によりシンテターゼの語尾を持つ酵素が多い。すなわち、化合物XとYとをATP加水分解に共役して結合させる酵素は系統名ではX:Yリガーゼと命名されるが、常用名ではX-Yシンテターゼと命名される[5]。例えばアシルコエンザイムAシンテターゼは脂肪酸〈アシル基〉とコエンザイムAとをATP分解のエネルギーを利用して合成する酵素である。[6] 一覧EC.6.1.-(炭素-酸素結合を形成するもの)EC 6.1.1.- (アミノアシル-tRNAおよび関連化合物を生成するリガーゼ)
EC 6.1.2 (酸-アルコールリガーゼ(エステルシンターゼ))EC.6.2.-(炭素-硫黄結合を形成するもの)EC.6.2.1.-(酸-チオールリガーゼ)EC.6.2.1.1 アセチルCoAシンテターゼ
EC.6.3.-(炭素-窒素結合を形成するもの)EC.6.3.1.-(酸-アンモニア(またはアミン)リガーゼ(アミドシンターゼ))
EC.6.3.2.-(酸-D-アミノ酸リガーゼ(ペプチドシンターゼ))
EC.6.3.3.-(シクロリガーゼ)
EC.6.3.4.-(その他の炭素-窒素リガーゼ)
EC.6.3.5.-(グルタミンがアミド-N-供与体となる炭素-窒素リガーゼ)
EC.6.4.-(炭素-炭素結合を形成するもの)
EC.6.5.-(リン酸エステル結合を形成するもの)EC.6.6.-(窒素-金属結合を形成するもの)EC 6.6.1 (錯体を形成するもの)出典
関連項目
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
リパーゼ リパーゼ (lipase) は、脂質を構成するエステル結合を加水分解する酵素群である。語源は、ギリシャ語の“lipos(脂肪)”+“ase(酵素)”に由来する。普通はそのうちで特にトリグリセリド(グリセロールの脂肪酸エステル)を分解して脂肪酸を遊離するトリアシルグリセリドリパーゼ(EC 3.1.1.3)を指す。消化液(胃液、膵液)に含まれ、脂質の消化を行う消化酵素であり、多くの生物の細胞で脂質の代謝に関与する。 リパーゼはすべての生物に存在し、その遺伝子は一部のウイルスにもある。機能も立体構造もさまざまであるが、活性中心にセリン(求核性の酸素原子を持つ)と酸性アミノ酸残基(アスパラギン酸など)およびヒスチジンを持つタイプが多い。 基質のグリセロール骨格の特定の位置(3か所のいずれか)を分解するものが多い。また逆反応(エステル合成)にも働くことから、人工的なエステル合成・交換反応にも用いられている。その際、目的とするエステルの加水分解を避けるため、有機溶媒中で反応が実施されることもある。また、リパーゼのその他の利用用途として消化薬、あるいは洗剤などに添加される。 広義のリパーゼとしては、リン脂質(生体膜の主成分)を分解する各種のホスホリパーゼがある。これらはエイコサノイド(プロスタグランジンなど)の合成や、細胞内でのシグナル伝達といった、細胞内外での機能調節に関与する。 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
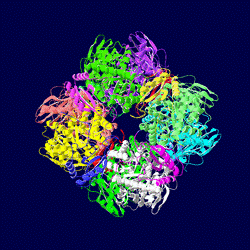
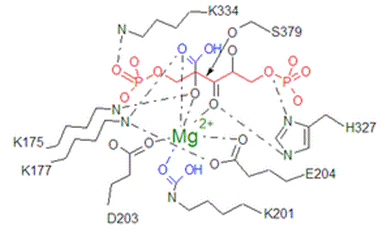
リブロース1,5-ビスリン酸カルボキシラーゼ/オキシゲナーゼ
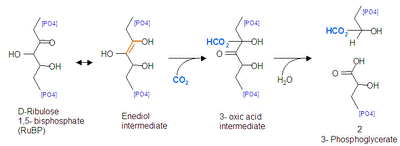
リブロース-1,5-ビスリン酸カルボキシラーゼ/オキシゲナーゼ (ribulose-1,5-bisphosphate carboxylase/oxygenase) はカルビン - ベンソン回路において炭酸固定反応に関与する唯一の酵素である(EC番号は 4.1.1.39)。リブロース1,5-ビスリン酸に二酸化炭素を固定し2分子の3-ホスホグリセリン酸を生成する反応を触媒する。植物に大量に含まれ、地球上で最も多いタンパク質ともいわれる。具体的にはホウレンソウの葉の可溶性タンパク質の5-10%は本酵素に占められる。 リブロース-1,5-ビスリン酸カルボキシラーゼ/オキシゲナーゼ本来の生理学的な役割はリブロース 1,5-ビスリン酸 (RuBP) へのカルボキシル化(カルボキシラーゼ反応)であるために、リブロース-1,5-ビスリン酸カルボキシラーゼが正しい呼称である。しかし本酵素は植物の炭素固定反応を律速している主原因となるリブロース 1,5-ビスリン酸へのオキシゲナーゼ作用(オキシゲナーゼ反応)が特徴的であり、この両反応の競合関係にあるためリブロース-1,5-ビスリン酸カルボキシラーゼ/オキシゲナーゼと呼称されることが多い。 呼称の長さから Ribulose 1,5-bisphosphate carboxylase/oxygenase の各文字をとって RubisCO と表記されることが多い。他の別名として、リブロース1,5-ビスリン酸カルボキシラーゼ、RuBPカルボキシラーゼ、Rubisco、RuBisCO、ルビスコなど。 カルボキシラーゼ反応RubisCOは生理学的に以下の反応を触媒する。括弧内は炭素数を意味する。 D-リブロース1,5-ビスリン酸 (C:5) + CO2 (C:1) + H2O → 2 × ホスホグリセリン酸 (C:3 × 2) この反応の補因子としてマグネシウムイオン (Mg2+) を要求する。この反応の平衡は著しく右方向に寄っており、逆反応はほとんど起きない。この反応はカルビン - ベンソン回路におけるカルボキシル化過程であり、本代謝系に唯一固有な反応である。カルビン-ベンソン回路における他の反応は、すべて解糖系あるいはペントースリン酸経路に見られる。したがってカルビン-ベンソン回路はRubisCOのカルボキシラーゼ反応によって調節される。RubisCOによるカルビン-ベンソン回路の調節については後述する。
カルボキシラーゼ反応は詳細に分類すると以下のステップを経る。
RubisCOはきわめて分子活性 (kcat) の低い酵素であり、3 s−1程度である(酵素1分子で1秒当たり3分子のCO2を固定する)。 カルビン-ベンソン回路の調節暗所に置いた植物細胞に光照射すると炭酸固定速度がしばらく低い状態が続くが、次第に定常速度に到達する。これは、暗所でカルビン-ベンソン回路に関与する複数の酵素の活性が低下しているからである。RubisCOもそうした酵素のひとつである。しかしRubisCOは光そのものによって活性化されるわけではなく、以下の要素によって活性化される。
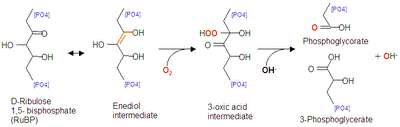
光によるRubisCO活性化と深く関わっているのは弱アルカリによる活性化である。光照射により葉緑体において光化学反応が起き、チラコイド内にプロトン (H+) が取り込まれるが、このときストロマ内のpHが上昇する。RubisCOはストロマ内に局在しており、活性化を受ける。また、チラコイドのプロトンの取り込みと同時に膜電位上昇に伴うMg2+の輸送がチラコイドからストロマ側に行われ、ここでもRubisCOの活性化を促進する。チラコイド、ストロマなどの構造は葉緑体の項を参照。 RubisCOは基質である重炭酸イオンの濃度上昇によって最大速度が上昇し、本酵素がアロステリック酵素であることを示している。また、RubisCOのカルボキシラーゼ反応の阻害剤となりうる2-カルボキシアラビニトール一リン酸は夜間に存在量が多く、昼間には低下する。さらにATP要求性RubisCO活性化酵素も、光化学反応によりストロマ側のATP濃度が上昇が活性化の鍵となる。すなわち、暗所では全ての要素が逆転し、RubisCOのカルボキシラーゼ反応を阻害する方向に働く。 オキシゲナーゼ反応強光下で光合成を行っていた植物細胞を21%O2濃度条件(通常の大気)における暗所に移動した場合、直後に大量のCO2放出が見られる。同様の実験を1.5%O2濃度条件の暗所に移動した場合、CO2の放出は観察されなくなる。明条件におけるCO2の放出を光呼吸というが、この原因になっている主反応がRubisCOのオキシゲナーゼ反応である。光呼吸は同化したCO2を再放出する過程であり(植物の生育速度の低下)、多くの主要作物(小麦、米、豆類など)でこの現象が見られることから収量上昇など経済的にも注目されている。RubisCOのオキシゲナーゼ反応は以下のとおりである。 リブロース1,5-ビスリン酸 + O2 → 3-ホスホグリコール酸 + 3-ホスホグリセリン酸 一見、CO2は放出されていないように見えるが、3-ホスホグリコール酸がペルオキシソームおよびミトコンドリアを経て代謝されCO2を放出する。3-ホスホグリセリン酸はそのままカルビン-ベンソン回路にて還元過程に入る。また、実際にCO2を放出する反応のみならず、オキシゲナーゼ反応がカルボキシラーゼ反応と競合し阻害することによって、見かけのCO2放出量を増加させ、光合成能率の低下を招く。
オキシゲナーゼ反応は詳細に分類すると以下のステップを経る。
上記のカルボキシラーゼ反応と比較して、反応ステップは極めて似通っており両反応が競合するのも、こうした酵素的な諸反応が類似していることが原因である。 RubisCOがオキシゲナーゼ活性を有する原因として、活性中心へのO2分子の取り込まれやすさが考えられる。RubisCOを有する光合成生物が出現した当初、地球上の大気組成は現在よりも還元的でCO2濃度が高かったと考えられており、こうした欠点は表在化しなかった。しかしながら、陸上植物の台頭により大気中の酸素分圧の上昇そして二酸化炭素分圧の低下を招き、RubisCOの欠点が光呼吸という形で現れてきたと考えられている。 RubisCOのカルボキシラーゼ/オキシゲナーゼ活性比とCO2/O2比の関係を表す値を「CO2補償濃度」といい、自然に起きている暗呼吸と光呼吸がつりあい、みかけのCO2放出速度が0になる。一般的なC3植物のCO2補償濃度は50–100 ppmである。また、CO2補償濃度以外のRubisCOの能力を示す値として、任意のCO2/O2濃度におけるカルボキシラーゼ/オキシゲナーゼ活性比である「τ値」が挙げられる。一般的に、陸上植物型のRubisCO (Form I) は嫌気性光合成細菌のRubisCO (Form II) に比べて、高酸素分圧条件に適応した痕跡が見られ、CO2補償濃度およびτ値において優れた値を示す。Form I、IIについては後述する。 RubisCOの生物界における分布RubisCOを有している生物として陸上高等植物、藻類、渦鞭毛藻類など真核生物のほか、シアノバクテリア、嫌気性光合成細菌、化学合成独立栄養細菌といった多くの原核生物(真正細菌、古細菌)があげられる。RubisCOは一般的にForm IおよびForm IIに分類されるが、古細菌から見つかっているRubisCOはどちらのFormにも属さない第3のRubisCOを有する事が分かっている。また、最近RubisCOに必要なアミノ残基を欠くRubisCO-like proteinが真正細菌および古細菌の両方から見つかっている。
Form IForm Iの特徴は以下のとおりである。
Form IIForm IIの特徴は以下のとおりである。
Form III古細菌型RubisCO (Form III) の特徴は以下のとおりである。
Form IVRubisCO-like protein (Form IV) の特徴は以下の通りである
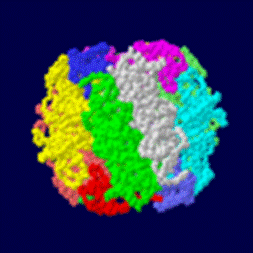
立体構造上述したようにRubisCOは地球上で最も存在量の多いタンパク質である。そのため、歴史的にも構造生物学的研究が進んだ酵素の一つであった。1971年に最初のRubisCO結晶が得られたものの、最初のX線結晶構造が明らかになったのは1990年のことであった。 まずはじめに得られた立体構造は紅色非硫黄細菌 Rhosdospirillum ruburm のForm II RubisCOである。解析の結果、Form IIは同一のサブユニット2個が対称性を持って結合している、分子量100 kDa程度のホモ2量体であることがわかった。Form I RubisCOの立体構造は同年にタバコ葉のものが明らかになった。Form Iは大サブユニット2個、小サブユニット2個のL2S2単位が計4個対称性を持って結合している分子量550 kDa程度のL8S8型であることが明らかになった。結晶化から立体構造の把握まで非常に時間がかかったことに関して、分子量が極めて大きく高い解像度を得られなかったことが原因と考えられている。 その後、多くの生物からForm I、II RubisCOの立体構造が明らかになった。また、基質や生産物を加えながら結晶化を行なうことにより、多くの反応中間体と思われる構造が得られた。具体的にはリブロース1,5-ビスリン酸と構造の良く似たカルボキシアラビニトールビスリン酸 (CABP) やマグネシウム-二酸化炭素複合体、カルシウム-二酸化炭素複合体、キシルロースビスリン酸 (XuBP)、そして生成産物である3-ホスホグリセリン酸 (PGA) などである。 また、2001年に古細菌型である Thermococcus kodakaraensis のForm III RubisCOの立体構造が明らかになった。遺伝子配列など、既知のRubisCOと相同性の低かったForm IIIは立体構造も他のFormと大きく異なっており、同一のサブユニット2個が対称性を持って結合しているL2単位が計5個対称性を持って結合している分子量497 kDa程度のL10型であることが明らかになった。 構造生物学的な触媒過程
立体構造が明らかになると同時に、サブユニットの機能についても明らかになった。Form Iにおける大サブユニットはカルボキシラーゼ/オキシゲナーゼ活性を有する触媒部位を有し、小サブユニットは機能未知な部分が多いが反応の調節を行なっているのではないかと考えられている。小サブユニットの無いForm I RubisCOでは活性が1%程度に落ち込むことが大腸菌発現系を用いた研究でわかっており、何らかの形でカルボキシラーゼ活性に関わっていることも示唆された。 Form II、IIIのサブユニットはForm I 大サブユニットと同様、触媒部位を有しており、基本的には以下に述べる基質の結合過程に従うと考えられる。触媒過程における最も多くの反応中間体が得られているのはホウレンソウのForm I RubisCOである。
これらの反応素過程において注意すべきなのは、K201にカルバミル化される二酸化炭素は基質として取り込まれるわけではない、という点である。基質として取り込まれるべき二酸化炭素は、Mg2+-CO2複合体および糖が配位したときに、3-オキソ中間体となるようリブロース1,5-ビスリン酸の2位にカルボキシル化される。 遺伝子改変系による機能改良RuBisCOは上述したように、リブロース1,5-ビスリン酸へのカルボキシラーゼ反応という特有の反応を触媒するが、同時にオキシゲナーゼ反応も担うという酵素的な欠点も抱えている。また、比活性も低くカルビン-ベンソン回路の律速段階となっている。RubisCOのこうした欠点を克服することは主要作物の増産や地球温暖化防止の点においても極めて大きな影響を与えると考えられ、大腸菌を用いた遺伝子の突然変異法などによりその機能の改良が試みられてきた。近年のRubisCOの改良に関する総説によると[1]、求められるべきPerfect RubisCOとは以下の条件を満たすものである。
現実のRubisCOは紅色非硫黄細菌 Rhodospirillum rubrum の場合、比活性が高いもののミカエリス-メンテン定数が高く、高CO2濃度に適応している。一方、タバコのRubisCOは比活性は低いが、ミカエリス-メンテン定数が低いため、低CO2濃度に適応している。この結果、現状で最も1.の条件を満たしているRubisCOはタバコとなりその値は kcat/Km = 3.2 × 105 である。タバコRubisCOのミカエリス-メンテン定数 (Km = 10.7 μM) を参考にした場合、逆算されうるPerfect RubisCOの比活性は1070 s−1となり、既存のRubisCOの100倍以上である。 2006年にシアノバクテリア Synechococcus PCC7492のRubisCO遺伝子の大量のランダム変異体を獲得し、大腸菌内でRubisCOが機能する場合にのみペントースリン酸経路の一部を用いたカルビン-ベンソン回路によって発現宿主が生育可能になる系にて優れたRubisCOの選抜を行なった報告がある[2]。本系では、RubisCO遺伝子の変異のみで発現量が野生型の約15倍あるいは比活性が5倍になるRubisCO変異体が得られている。このような、発現量の増大や比活性の向上が見られる理由は構造生物学的に明らかになっていないが、RubisCO自身の安定性に寄与している変異が導入されている事が一因と考えられている。本系を上手く応用することにより、今後さらに優れたRubisCO変異体が得られるのではないかと期待されている。 参考文献
関連項目
<img src="//ja.wikipedia.org/wiki/Special:CentralAutoLogin/start?type=1x1" alt="" title="" width="1" height="1" style="border: none; position: absolute;" /> 「https://ja.wikipedia.org/w/index.php?title=リブロース1,5-ビスリン酸カルボキシラーゼ/オキシゲナーゼ&oldid=64309738」から取得 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
リボヌクレアーゼA RNAアーゼAの構造 リボヌクレアーゼA(Ribonuclease A)は、一本鎖RNAを切断するエンドヌクレアーゼの1つである。RNAアーゼA(RNase A)とも言う。子牛の膵臓のRNAアーゼAは、古典的なタンパク質科学のモデル系として用いられた。 目次
歴史 子牛の膵臓由来のRNAアーゼAは、アメリカ合衆国の食肉会社Armour and Companyがkg単位で精製し、興味のある科学者に10mgずつ無料で提供したことから広く使われるようになった。この入手の利便性によって、RNAアーゼはタンパク質研究のモデルとなった。 RNAアーゼは研究の素材として、吸光、円偏光二色性、旋光分散、ラマン分光法、電子スピン共鳴、核磁気共鳴分光法など様々な分光学的分析手法を生み出した。また限定分解、側鎖の化学修飾、抗原認識などいくつかの化学的構造分析法の発展にも貢献した。 1967年にはタンパク質として3番目に構造が解かれている[1]。 RNAアーゼAの酸化的フォールディングの研究から、クリスチャン・アンフィンセンはタンパク質のフォールディングに関して熱動力学仮説を立て、タンパク質のフォールドは自由エネルギーが最小になるように決まるとした。 さらに、RNAアーゼAはマルチプルアライメントによる解析が初めて行われたタンパク質、進化的な特徴が比較された初めてのタンパク質でもある。 構造と特徴 RNAアーゼAは124残基、13.7kDa以下と比較的小さいタンパク質である。2層のα+βからなり、タコスのように2つに折り畳まれて、中央の溝がRNA結合部位になる。N末端側の1番目の層は3つのαヘリックスからなり、C末端側の2番目の層は2つのβシート中に2つのβヘアピンが配置した構造からなっている。 RNAアーゼAは、Cys26-Cys84、Cys58-110、Cys40-95、Cys65-72という4つのジスルフィド結合を持つ。最初の2つはフォールディングに必須で、それぞれが第1層のαヘリックスと第2層のβシートを結合して疎水中心を作っている。後の2つはフォールディングには必須ではなく、どちらかを欠いても構造は変わらない。これらはループをつなげて溶媒に露出させる。興味深いことに、最後のジスルフィド結合はループのエントロピーに比べて結合を非常に形成しやすい。これはこの部分のβヘアピンの形成しやすさを反映していると考えられる。 RNAアーゼAは等電点が約8.63の塩基性のタンパク質であり、多数の陽電荷がRNAとの結合に関与する。さらに一般的に言うと、RNAアーゼは非常に極性が大きく、疎水性基が少ない。このため、構造の安定化のために4つものジスルフィド結合が必要となる。 酵素としての機能 RNAアーゼAの陽電荷は主に溝の周りに分布している。RNA分子が溝の位置に来ると2つのヒスチジンHis12とHis119によって切断される。中間体は近辺にある3つのリシンLys7、Lys41、Lys66によって安定化される。 抗がん作用 RNAアーゼAやそのオリゴマー、ホモログは、特にガン細胞に対しての細胞毒性、細胞増殖抑制の作用を持っている。この効果を使って、RNAアーゼのホモログであるオンコナーゼからリボヌクレアーゼ薬剤が作られ、特に皮膚がんの外用薬として用いられている。 その他の生理活性[編集] RNAアーゼは、血管の発達に関与するアンギオジェニンとも関わっている。 出典 ^ Wyckoff HW, Hardman KD, Allewell NM, Inagami T, Johnson LN, Richards FM. The structure of ribonuclease-S at 3.5 A resolution. J Biol Chem. 1967 Sep 10;242(17):3984-8. PMID 6037556 D'Alessio G and Riordan JF, eds. (1997) Ribonucleases: Structures and Functions, Academic Press. Raines RT. (1998) "Ribonuclease A", Chem. Rev., '98, 1045-1065. Scheraga HA, Wedemeyer WJ and Welker E. (2001) "Bovine Pancreatic Ribonuclease A: Oxidative and Conformational Folding Studies", Methods Enzymol., 341, 189-221. タンパク質の三次構造 全般 タンパク質ドメイン フォールディング タンパク質構造 αフォールド ヘリックスバンドル グロビンフォールド ホメオドメインフォールド αソレノイド βフォールド 免疫グロブリンフォールド βバレル βプロペラドメイン α/βフォールド TIMバレル ロイシンリッチリピート フラボドキシンフォールド チオレドキシンフォールド 三葉結び目フォールド α+βフォールド フェレドキシンフォールド リボヌクレアーゼA SH2ドメイン イレギュラードメイン コノトキシン ←二次構造 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
れ レニン
レニン(Renin, EC.3.4.23.15)はアンジオテンシノーゲンのペプチド結合を分解してアンジオテンシンIを合成するタンパク質分解酵素の一種。アンジオテンシノーゲン中の非常に特異的なペプチド配列を認識し分解するため、発見当初は活性化の仕組みがわからずホルモンかキナーゼの一種ではないかと考えられていた。 作用機序レニン-アンギオテンシン-アルドステロン系は生物が進化して海生から陸生になるに伴って起こるナトリウムの損失による循環血流量の減少を補うために進化した仕組みである。 腎臓の傍糸球体細胞から分泌され、血圧調節に関わるアンジオテンシンIを活性化する。したがって、この酵素は間接的に血圧を調節する。またレニン酵素タンパク質の遺伝子の活性が強いと高血圧になりやすくなる。腎臓の傍糸球体細胞が腎血流量の変化を感知し、減少すればレニンの分泌を促進し、増加すれば抑制する。レニンによって活性化されたアンジオテンシンIは作用が強力なアンジオテンシンIIに変化する。アンジオテンシンIIはそれ自体が血圧上昇作用を持つほか、アルドステロンの分泌を促進し、腎におけるナトリウムの再吸収を増加させるため、血液量の減少を抑制する。これをレニン-アンジオテンシン-アルドステロン(RAA)系という。また、アルドステロンによってネガティブフィードバックを受けている。そのため、原発性アルドステロン症などでアルドステロンの分泌が増加するとレニン活性は低下する。 全身の血流量ではなく腎血流量のみで分泌量が決定するため、腎動脈の何らかの障害で腎血流量が減少したときの腎血管性高血圧症の誘因となる。 ただし、レニン-アンギオテンシンーアルドステロン系は塩分とそれに伴う水分の喪失により腎臓血流量が低下した場合に循環血流量を確保するために進化した系統である。したがって、現代人のように塩分が過多の状況ではレニンの分泌は抑制されている。 このため塩分過多の状況ではアンギオテンシンII変換酵素阻害剤(ACE阻害剤)やアンギオテンシンIIレセプターブロッカー(ARB)などの降圧効果は穏やかのものにとどまる。このため、現時点の治療としては、依然として塩分の制限が中心であり、これにカルシウム拮抗剤や利尿剤を組み合わせた配合錠が広く使われるようになっている。 歴史レニンは、1898年にカロリンスカのRobert Tigerstedtによって発見された。また、1983年に、筑波大学の村上和雄教授が「ヒト・レニン」の遺伝子解読に成功した。
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
レンネット レンネット (Rennet) とは、母乳の消化のために数種の哺乳動物の胃で作られる酵素の混合物のことで、チーズの製造に用いられる。凝乳酵素とも呼ばれる。主な活性酵素はキモシン(chymosin、EC 3.4.23.4) である。 概要[ 元来は、偶蹄目(ウシ、ヒツジ、ヤギ)の哺乳期間中の第4胃袋(ギアラとも呼ばれる)に存在する。この中でも、仔牛由来のものはカーフレンネットと呼ばれ、珍重されている。現在、通常はカビからとれるものや、遺伝子組換によって微生物から得られたものを多く利用する。 ウシ、ヤギなどの第4胃袋の消化液の抽出物が、標準レンネットと呼ばれる。若い仔牛の消化液には、キモシン88~94%とペプシン6~12%が含まれているといわれ、乳離れするとキモシン分泌量が急激に減少する。草を食べ始めるころになると、キモシンとペプシンの含有量が逆転し、ほぼペプシンのみとなる。この推移は他の偶蹄目でもみられ、やはり草を食む頃になるとペプシンが多くなってくる。このペプシンはタンパク質分解酵素であるため、成長した家畜の消化液を使っても凝集は起こらず、チーズを作ることは出来ない。 歴史 ヨーロッパでは長い間、チーズ作りの材料に偶蹄目由来のレンネット(ペプシンレンネット)が用いられてきた。消化液は反芻運動(嘔吐)では集められないため、家畜を屠殺して胃を取り出して消化液を集める必要がある。このため、安定供給が受けられず、大量の家畜が必要となるため酪農家の負担も大きかった。やがて、1960年代に原料の元となる家畜不足を原因として、代替物が多く用いられはじめることとなった。この際、ケカビ M.プシルス(Mucor Pusillus) が生成するレンネットが注目されることとなった。微生物レンネットと呼ばれるこれは全世界で用いられているが、伝統の維持などの観点からペプシンレンネットだけしか認めていない場合もある。 古代ギリシアの叙事詩『イーリアス』には植物性のレンネットに関するくだりがある。アリストテレスの『動物誌』にもイチジクの樹液を使った凝乳作用の説明がある。他にも、古代ギリシアやローマ時代の記録に酢、ベニバナの種、カルドン、アーティチョークの花、カワラマツバなどの植物をレンネットとして挙げている。これらの植物性レンネットは、ほとんど廃れてしまったが、今日でもイベリア半島やクレタ島の数種類のチーズに伝統が残っている。 レンネットによる乳凝固の原理 レンネットを加える前段階で、まず乳を乳酸発酵させる。無殺菌の乳では環境微生物中の乳酸菌により乳酸発酵が起こるが、殺菌乳では多くの場合、人為的に乳酸菌を加える。乳酸発酵した乳は酸性になり、カルシウムイオンが増加する。 乳中でカゼインなどの蛋白質(カゼインミセルという直径20~600μの分子を形成している)は−の電気を帯びており、互いに反発しあって凝集することはない。特にκカゼインはカルシウムイオンに対して安定で、このためカゼインミセルはこのままでは沈殿しない。 ここでレンネットを加えると、プロテアーゼであるレンニンがκカゼインに作用してその結合を切断する。結果、κカゼインは浮遊力を失って不安定になり、カゼインミセルから分離する。そして−の電気が弱まったカゼインミセル同士がカルシウムイオンを介してくっつき、脂肪球と共に沈殿凝固する。これが乳の凝固の原理である。 関連項目 レンネットテスト カード (食品) 参考文献 『ミルク総合辞典』 編者:山内邦男、横山健吉 出版:朝倉書店 ISBN 4254430485 『菌類図鑑(上)』 著者:宇田川俊一 出版:講談社 ASIN B000J8R37G アンドリュー・ドルビー; 久村典子訳 『チーズの歴史』 ブルース・インターアクションズ、2001年。ISBN 9784860204266。 外部リンク チーズ塾 レンネットについて カテゴリ: チーズ酵素ペプチダーゼ |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||