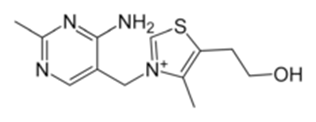
酵素-4(た)
|
た ターンオーバー数 ターンオーバー数(ターンオーバーすう、turnover number)、もしくは 回転数(かいてんすう) という用語は、化学において以下の2通りに用いられる。 代謝回転数 酵素化学において 代謝回転数(たいしゃかいてんすう)は、酵素が活性部位ごとに、単位時間あたりにどれだけの数の基質を生成物に変換できるかの最大数を示す。kcat と表され、下式で求められる。 kcat = Vmax/[E]0 (Vmax は反応速度の最大値、[E]0 は酵素の活性部位の全濃度。ミカエリス・メンテン式を参照) 例えば炭酸脱水酵素は 400,000 から 600,000 s−1 の回転数を持つ。すなわち、それぞれの炭酸脱水酵素の分子が1秒あたり 600,000個もの炭酸水素イオンを生み出すことを示す[1] 触媒回転数 触媒化学において 触媒回転数(しょくばいかいてんすう)とは、ある触媒反応において、触媒が不活性化するまでに1モルあたり何モルの基質分子を生成物に変換したかを示す。TON (turnover number) と略される。不活性化しない理想的な触媒では回転数は無限大ということになる。上記の代謝回転数のように速度を表すパラメーターは、回転頻度、ターンオーバー頻度 と呼ばれ、TOF (turnover frequency) と略される。 脚注 ^ Hagen J (2006). Industrial Catalysis: A Practical Approach. Weinheim, Germany: Wiley-VCH. この項目は、化学に関連した書きかけの項目です。この項目を加筆・訂正などしてくださる協力者を求めています(プロジェクト:化学/Portal:化学)。 カテゴリ: 酵素触媒化学反応反応速度論 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
代謝マップ 代謝マップ(たいしゃマップ)とは、代謝の中でも特に生物における代謝経路(パスウェイ)あるいはそれらからなるネットワークを図式化したものをいう。 代謝マップは有向グラフであり、ノードが代謝を受ける化合物を、エッジが化学反応あるいはそれを触媒する酵素を示す。 ウェブ上で公開されている代謝マップも幾つかあり、図上の酵素をクリックするとその詳細情報へリンクするようにしたものが多い。また類似の図式としてシグナル伝達などの経路・ネットワークを示したものもある。 中でもバイオインフォマティクス研究用ツールとして注目されるのがKEGG(京都遺伝子・ゲノム百科事典)である。これは遺伝子・ゲノムの情報を中心に据えた総合データベースだが、代謝・シグナル伝達等のマップと、各酵素とその遺伝子および基質・代謝物の情報が互いにリンクしており、関連した経路、遺伝子の類似性と機能との関係、生物種による違いなどを検索することができる。 外部リンク KEGG PATHWAY DatabaseKEGG代謝マップデータベース(1. Metabolismを見よ) Reactome 各種パスウェイなどの公共データベース。 簡易な代謝マップ基本的な代謝のマッピングとその解説。 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
ダイニン この記事は検証可能な参考文献や出典が全く示されていないか、不十分です。 出典を追加して記事の信頼性向上にご協力ください。(2014年11月) ダイニン (英語:dynein) は、分子モーターの一種で、ATPを加水分解して得られるエネルギーで微小管上を運動するタンパク質複合体である。真核生物の鞭毛・繊毛の運動を生み出すタンパク質として同定された[1]。このダイニンは現在では、軸糸ダイニン(axonemal dynein)あるいは鞭毛ダイニン(flagellar dynein)と呼ばれる。また後に細胞内での様々な分子の移動に関わっている種類も存在することが明らかとなり、このクラスは細胞質ダイニン(cytoplasmic dynein)と呼ばれる。 これまでで知られる全ての亜種が微小管のマイナス端方向に移動する。つまり、ダイニンは、鞭毛・繊毛内のintraflagellar transport(毛内輸送)では末端から細胞体に向けての逆行性輸送、細胞体内では中心体に向けた向心性輸送に関わる。鞭毛・繊毛内の軸糸ダイニンは、波打ち運動に関わる。 ダイニンの構造 ダイニンの機能単位は複数のポリペプチド鎖から成り、1-3の重鎖、数種の中鎖、及び軽鎖から形成される。その形態は一般に2つの重鎖それぞれが形成する頭部と、頭部から突き出たストークと呼ばれる部位、さらに柄の部分が基本となり、中鎖や軽鎖は柄の部分に結合している。ダイニンはストークの先端で微小管に結合し、微小管上を運動すると考えられている。 重鎖 ダイニン重鎖はダイニンの骨格を形成し、かつATPのエネルギーを運動に変化する機能を持つ。重鎖のアミノ末端が柄の部分となり、これはダイマー形成や、他のダイニン形成分子との相互作用を担う。中央部からカルボキシル末端にかけてはリング状の頭部を形成し、6個のAAA+ ATPアーゼファミリーに属するドメインと、一つのC末端ドメインが形成する7個のサブユニット様構造となる。AAA+ ATPアーゼドメイン4と5の間に存在する100アミノ酸残基程度の領域がストークとして突き出た部分となって微小管と作用すると考えられている。ATP が結合するのは6個の中でも始めの4個のAAA+ ドメインで、さらに始めの一つのドメインのみが ATPアーゼ 活性を持つとされる。 中間鎖・軽鎖 ダイニン重鎖に強く結合している分子量150~10 kDaの分子種は中間鎖及び軽鎖と呼ばれる。これらのタンパク質はダイニンの構造タンパク質としての機能、あるいは細胞質ダイニンが輸送する分子との相互作用を担うと考えられている。 脚注 ^ Gibbons I. R (1963). “Studies on the protein components of cilia from tetrahymena pyriformis”. Proc Natl Acad Sci U S A 50: 1002-1010. PMID 14082342.
この項目は、自然科学に関連した書きかけの項目です。この項目を加筆・訂正などしてくださる協力者を求めています(Portal:自然科学)。 カテゴリ: タンパク質タンパク質複合体モータータンパク質細胞生物学細胞骨格酵素 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
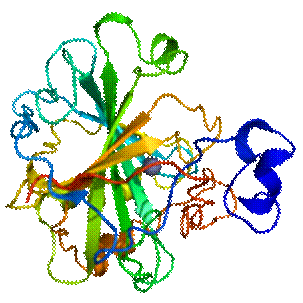
タカアミラーゼA タカアミラーゼA(Taka-amylase A)は、コウジカビAspergillus oryzae由来のα-アミラーゼであり、典型的なα-アミラーゼ。 概要 明治26年(1839年)に高峰譲吉がAspergillus oryzaeの小麦麩(ふすま)に麹菌を働かせた麹麩から、タカジアスターゼを発明した。このタカジアスターゼの原末には、タカアミラーゼA、グルコアミラーゼ、プロテアーゼ、リパーゼなどの多くの酵素が含まれていた。1951年に赤堀四郎が初めてこの原末からタカアミラーゼAの結晶化に成功し、その30年後(1984年)に、松浦らによってX線結晶構造解析がされた。α-アミラーゼのモデル構造[1]。 関連項目 アミラーゼ 高峰譲吉 出典 ^ 『澱粉の科学と技術』 ISBN 978-4990528706 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
脱炭酸酵素 ホウレンソウRubisCOの立体構造(リボンモデル) 脱炭酸酵素(Carboxy-lyases)は、有機化合物にカルボキシル基を加えたり除いたりする炭素-炭素結合のリアーゼである。デカルボキシラーゼ(decarboxylass)とも言う。これらの酵素はアミノ酸、α及びβケト酸等の脱炭酸を触媒する[1]。 分類と命名 脱炭酸酵素は、EC番号4.1.1に分類される[2]。例えばピルビン酸の脱炭酸を触媒する酵素はピルビン酸デカルボキシラーゼ(ピルビン酸脱炭酸酵素)と呼ばれるように、通常、触媒する基質の名前を取って命名される。 例 環状L-アミノ酸デカルボキシラーゼ グルタミン酸デカルボキシラーゼ ヒスチジンデカルボキシラーゼ オルニチンデカルボキシラーゼ ホスホエノールピルビン酸デカルボキシラーゼ ピルビン酸デカルボキシラーゼ RuBisCO - 二酸化炭素を固定する唯一の脱炭酸酵素 ウリジル酸デカルボキシラーゼ ウロポルフィリノーゲンIIIデカルボキシラーゼ 外部リンク Carboxy-Lyases - MeSH、米国国立医学図書館、生命科学用語シソーラス (英語サイト) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
リアーゼリアーゼ(lyase)とはEC第4群に属する酵素で、脱離反応により二重結合を生成したり、逆反応の付加反応により二重結合部位に置換基を導入する反応を触媒する酵素である[1]。英語に従ってライエースと表記される場合もある[2]。日本語では除去付加酵素〈じょきょふかこうそ〉[3]とも呼ばれる。 概要リアーゼはその触媒する化学反応の種別により大きく6つに分類される
シンターゼリアーゼの別名の一つにシンターゼ〈synthase〉がある。 リアーゼの系統名は基質〈X〉と脱離する分子〈Y〉の名称にリアーゼの語尾をつけて、X:Yリアーゼと命名される。慣用名は語尾リアーゼの他に、生成物名称にシンターゼの語尾を付して命名される場合もある。特に、酵素の平衡が生成物側に偏っているときにシンターゼが用いられる[4]。 日本語ではシンターゼに「合成酵素」という語が充てられているが、シンターゼ以外のシンセターゼ〈EC第6群〉も合成酵素と呼ばれる為、合成酵素という日本語語尾からシンターゼかシンセターゼかを判断できない。 EC.4.-EC.4.1.-(炭素-炭素リアーゼ)EC.4.1.1.-(カルボキシリアーゼ)
EC.4.1.2.-(アルデヒドリアーゼ)
EC.4.1.3.-(オキソ酸リアーゼ)
EC.4.1.99.-(その他の炭素-炭素リアーゼ)
EC.4.2.-(炭素-酸素リアーゼ)EC.4.2.1.-(デヒドラターゼ)
EC.4.2.2.-(多糖に作用する)
EC.4.2.3.-(リン酸に作用)
EC.4.2.99.-(その他の炭素-酸素リアーゼ)
EC.4.3.-(炭素-窒素リアーゼ)EC.4.3.1.-(アンモニアリアーゼ)
EC.4.3.2.-(アミジンリアーゼ)
EC.4.3.3.-(アミンリアーゼ)
EC.4.3.99.-(他の炭素-窒素リアーゼ)
EC.4.4.-(炭素-硫黄リアーゼ)EC.4.5.-(炭素-ハロゲン化物リアーゼ)
EC.4.6.-(リン-酸素リアーゼ)
EC.4.7.-(炭素-リンリアーゼ)EC.4.99.-(その他のリアーゼ)出典
関連項目 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
炭酸脱水酵素
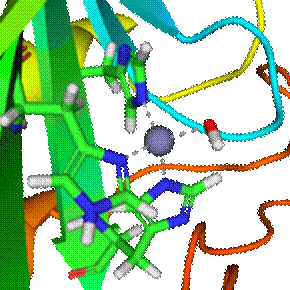
炭酸脱水酵素(たんさんだっすいこうそ、Carbonic anhydrase、carbonate dehydratase; 略号: CA)あるいは炭酸デヒドラターゼとは金属プロテイン酵素[1]に属する酵素で二酸化炭素と水を炭酸水素イオンと水素イオンとに迅速に変換する酵素である。この反応は触媒が存在しないときわめて遅い[2] 。炭酸脱水酵素はこの反応速度を非常に増大させる。反応速度はこの酵素の形態により異なり、104から106反応毎秒である.[3]。大抵のCAは活性中心に亜鉛イオンを含有する。 炭酸脱水酵素の構造と機能自然界の炭酸脱水酵素は幾つかの形態が存在する[4]。もっとも研究されているものが「α-炭酸脱水酵素」で動物の体内に存在する。亜鉛イオンは His94, His96そしてHis119である3つのヒスチジン残基のイミダソール環が配位している。 動物においてこの酵素の主たる機能は、二酸化炭素と炭酸水素イオンとを相互変換することで、血液や他の組織の酸-塩基平衡を維持し、組織から二酸化炭素を運び出す補助をする。 植物においては「β-炭酸脱水酵素」と呼ばれる形態の異なる酵素が含まれる。その酵素は進化的には起源を異にするが、同じ反応に関与し、活性中心には亜鉛イオンが存在する。植物において炭酸脱水酵素はCO2濃度の上昇を補助し、葉緑体中でリブロース1,5-ビスリン酸カルボキシラーゼ/オキシゲナーゼ酵素の炭酸固定反応を増大させている。この反応により光合成ではCO2ガスを有機化合物の糖に固定しているが、CO2の炭素のみが利用され、炭酸や炭酸水素イオンでは利用されない。 2000年にはカドミウム含有炭酸脱水酵素[5]が亜鉛が限定される海洋の珪藻から発見されている。大洋では亜鉛はその濃度は定常的に低い濃度であり、珪藻のような植物プランクトン生育の制限になりうる。そうした場合、炭酸脱水酵素は環境中で使用できる他の金属イオンを利用する。この発見以前は一般にはカドミウムは生物学的な機能がない非常に毒性のある重金属であると考えられていた。2005年の時点では炭酸脱水酵素に結合する例だけがカドミウムが関与する生化学反応である。 炭酸脱水酵素は次の反応を触媒する。
逆反応は相対的に遅い(速度定数は15秒程度である)。炭酸飲料が栓をあけたときにカンやビンでは速やかにガスが抜けずに、口に入れると急にガスが抜けるのは、唾液中に炭酸脱水酵素が含まれるためである。
反応機構
酵素の補欠分子族である亜鉛は3部位のヒスチジン側鎖に配位している。4つ目の配位座は水分子により占められている。水素-酸素結合は分極を生じ、酸素はわずかに陰性を帯びそれにより弱められている。 4番目のヒスチジンが近づくと基質の水からプロトンを受け取る。この例は典型的な酸-塩基触媒モデルである。そして亜鉛から水酸化物イオンが解離する。 活性部位も二酸化炭素に特異的なくぼみを持ち、水酸化物イオンを導入するのに都合が良い。この電子過剰の水酸化物イオンが二酸化炭素に攻撃を加え、炭酸水素イオンが生成する。 炭酸脱水酵素ファミリー炭酸脱水酵素には少なくとも5つの独立したファミリー (α, β, γ, δそして ε)が存在する。3つのファミリーは.アミノ酸配列にほとんど相同性はなく、平行進化が顕著に現れた例と考えられている。 α-CAこの炭酸脱水酵素は哺乳類から発見され、4つのサブグループに区分されている。
β-CA真正細菌と植物の葉緑体に存在する炭酸脱水酵素はβファミリーに属する。このファミリーは次に示す2種類の配列モチーフにより同定される。
γ-CAγクラスファミリーの炭酸脱水酵素はメタン菌(メタンを生産する古細菌)より見出されている。 δ-CAδクラスの炭酸脱水酵素は珪藻より見出された。この区分は最近[7]のもので、独立であるか疑問ももたれている。 ε-CAεクラスの炭酸脱水酵素は化学合成無機栄養細菌やCSO-Carboxysome[8] を持つ海洋の藍色細菌などの細菌にのみ見出される。 最近の3次元解析[7]によるとε-炭酸脱水酵素は、特に金属イオンサイト部位で、部分的にβ-炭酸脱水酵素と類似性をもつことが示唆されている。しかしこの二つのファミリーはかけ離れており、アミノ酸配列の点ではかなりかけ離れている。 関連項目外部リンク
出典1. ^ 酵素中に1つ以上の金属原子を酵素活性中心に持つもの。metalloenzymes 2. ^ Badger MR, Price GD. 1994. The role of carbonic anhydrase in photosynthesis. Annu Rev Plant Physiol Plant Mol Biol. 45:369–392 3. ^ Lindskog S. 1997. Structure and mechanism of carbonic anhydrase. PHARMACOLOGY & THERAPEUTICS. 74:1-20 4. ^ 酵素の分類命名は機能によってなされる為に、異なるアミノ酸配列のたんぱく質が同一酵素に区分される。 5. ^ cadmium containing carbonic anhydrase (英語) 6. ^ 炭酸のpKaはおよそ6.36 (実際の値は媒質に依存する)でありpH 7であり炭酸水素イオンのうちのわずかな部分がプロトン化しているだけである。HCO3- + H+ 7. ^ a b Sawaya MR, Cannon GC, Heinhorst S, Tanaka S, Williams EB, Yeates TO, Kerfeld CA. 2006. The structure of beta-carbonic anhydrase from the carboxysomal shell reveals a distinct subclass with one active site for the price of two. J Biol Chem. 281(11):7546-55 8. ^ So AK, Espie GS, Williams EB, Shively JM, Heinhorst S, Cannon GC. 2004. A novel evolutionary lineage of carbonic anhydrase (epsilon class) is a component of the carboxysome shell. J Bacteriol. 186(3):623-30. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
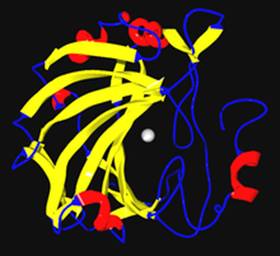
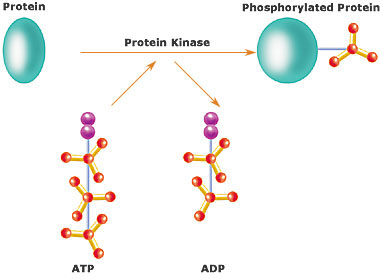
プロテインキナーゼプロテインキナーゼ (Protein kinase; プロテインカイネース) は、タンパク質分子にリン酸基を付加する(リン酸化する)酵素である。タンパク質キナーゼあるいは英語風にプロテインカイネースとも呼ぶ。キナーゼ(リン酸基転移酵素)の中でタンパク質をリン酸化するキナーゼをプロテインキナーゼと呼ぶが、このプロテインキナーゼのことを特にキナーゼと呼ぶことが多い(本記事では以後単にキナーゼという)。 概要細胞は、その機能を維持するため、細胞内のタンパク質をリン酸化、脱リン酸化する反応を繰り返している。このリン酸化によってタンパク質は酵素活性、細胞内での局在や他のタンパク質との会合状態を変化させる。細胞内の30%ものタンパク質がキナーゼによる変化を受け、細胞内における様々なシグナル伝達や代謝の調節因子として機能している。キナーゼ遺伝子はヒトゲノム中に約500種類があり、また真核生物の全遺伝子の約2%を占める。 キナーゼは、ATPのリン酸基をアミノ酸残基にあるヒドロキシ基に移動させ、共有結合させる活性を有する。キナーゼはアミノ酸のうち、主にセリン、スレオニン、チロシン残基をリン酸化させるが、キナーゼがリン酸化するアミノ酸の99%以上はセリン、スレオニンである(セリン/スレオニンキナーゼ)。しかし、0.1%に満たないチロシンのリン酸化(チロシンキナーゼ)の方が生物学的に重要なケースが多い。これら3種類すべてに反応するものや、またこのほかに微生物や植物ではヒスチジンのイミダゾール環窒素原子に反応するもの(ヒスチジンキナーゼ;EC 2.7.13に含まれる)もある。 キナーゼの活性は精密に調節されており、キナーゼ自身もリン酸化によってオン・オフ調節を受ける。これは他のキナーゼのみならず、自分自身によって行われることもあり、“自己リン酸化”という。これらの調節は他の活性化(または抑制)タンパク質や低分子化合物の結合、細胞内での局在変化などによって起きる。 キナーゼの機能異常は病気の原因になることも多い。特にがんに関して詳細な研究が行われており、キナーゼはがん細胞の増殖、移動、浸潤やアポトーシス(細胞死)の調節に関与する。特定のキナーゼを阻害することによって治療に役立てる薬物が開発されており、中にはゲフィチニブ(イレッサ®)やイマチニブ(グリベック®)のように、すでに臨床的に用いられているものもある。 セリン/スレオニンキナーゼセリン/スレオニンキナーゼ(Ser/Thr kinase; 読み:セリン/スレオニン カイネース、EC 2.7.11.*)はセリンまたはスレオニンのヒドロキシ基をリン酸化する。これらは によって調節される。これらのキナーゼの特異性は特定のアミノ酸配列に基づくものではなく、リン酸化される基質はキーとなる数個のアミノ酸(疎水結合やイオン結合による)でキナーゼと結合するから、普通、キナーゼはある性質を共有する「基質ファミリー」全体に対して特異的である。ほとんどのキナーゼは、本当の基質のようにキナーゼに結合するがリン酸化を受けるアミノ酸を欠くような「擬似基質」によって阻害される。擬似基質が取り除かれるとキナーゼは機能を取り戻す。これらのキナーゼの触媒部位は高度に保存されている。 セリン/スレオニンキナーゼには以前は一部を除いて独自のEC番号はなく、"EC 2.7.1.37"を用いていた。国際生化学分子生物学連合IUBMBの命名委員会(NC-IUBMB)によって見直しされ、2005年にそれぞれ独自のEC番号が割り当てられた。 ホスホリラーゼキナーゼホスホリラーゼキナーゼ(EC 2.7.11.19)は初めて発見された(1959年、エドヴィン・クレープスら)セリン/スレオニンキナーゼである。グリコーゲンホスホリラーゼ(グリコーゲンを加リン酸分解する酵素)を活性化する。 プロテインキナーゼAプロテインキナーゼA(AキナーゼまたはPKA、EC 2.7.11.11)は2つのドメインからなり、小ドメインはβシートを、大ドメインはαヘリックスを含む。基質とATPの結合部位は2つのドメインの間隙にある。ATPと基質が結合すると、2つのドメインは互いに回転するように動き、ATPの末端リン酸基と基質のターゲットアミノ酸が近寄って反応が起きやすい位置となる。 制御[Aキナーゼは細胞内でcAMPによる調節を受け、グリコーゲン、糖、脂質の代謝の調節など、いくつかの機能を有する。cAMPがないときは4量体(調節サブユニット2個と触媒サブユニット2個:R2C2)からなり、調節サブユニットが触媒サブユニットの活性中心を封鎖している。cAMPが調節サブユニットに結合すると、2個のRCに解離し、これが活性を有する。また触媒サブユニット自体もリン酸化によって調節される。Aキナーゼは次のようなフィードバック機構によってダウンレギュレーションされる:Aキナーゼによって活性化される基質の1つにホスホジエステラーゼがあり、これはcAMPをAMPに変換し、cAMP量を下げてAキナーゼの活性を低下させる。グリコーゲンの分解においては、Aキナーゼがホスホリラーゼキナーゼをリン酸化して活性化し、さらにこれがグリコーゲンホスホリラーゼをリン酸化して活性化するのである。 プロテインキナーゼC概要
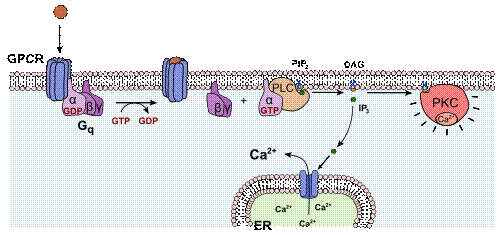
プロテインキナーゼC(プロテインキナーゼ・シー)あるいはPKC、Cキナーゼ (EC 2.7.11.13) は少なくとも10種類以上のアイソザイムから構成されるタンパク質ファミリーである。PKCは基質に存在するセリンおよびスレオニン残基のヒドロキシル基をリン酸化する。1977年に西塚泰美らによって発見された。PKCは、その構造、活性化機構、生理機能によって、在来型(conventionalあるいはclassical:α、βI、βII、γ)、新型(novel:δ、ε、η、θ)、非典型(atypical:ζ、λ/ι)の3つのサブファミリーに分類される。在来型PKCは主にカルシウムイオン(Ca2+)、ジアシルグリセロール (DAG, DG)、あるいはホスファチジルセリン (PS) などのリン脂質によって活性化される。新型PKCはカルシウムイオン結合活性を失っており、ジアシルグリセロールによる活性化を受ける。ジアシルグリセロールは細胞膜、核膜の構成成分であるホスファチジルイノシトール (PI) からホスホリパーゼCによって産生されるため、在来型・新型PKCはシグナル伝達経路においてホスホリパーゼCの下流に位置する。一方、非典型PKCはカルシムイオンおよびジアシルグリセロール結合活性を持たない。在来型PKCの1種であるCαを日本では特にCキナーゼと呼ぶことがある。 アイソザイム
構造と制御在来型PKCは、N末端側の調節領域とC末端側の触媒領域からなる。通常、PKCは調節領域に存在する偽基質領域による自己阻害作用のため不活性化状態で細胞質に存在し、セカンドメッセンジャー(カルシウムやジアシルグリセロール)によって活性化されると、細胞質に移行し基質をリン酸化する。 在来型PKCの調節領域には、連続した2つのC1ドメイン(ジアシルグリセロール結合ドメイン:C1AおよびC1B)とC2ドメイン(カルシウムイオン結合ドメイン)が存在する。新型PKCは、在来型と同様に連続した2つのC1ドメインを有しているが、在来型PKCのC2ドメインとホモロジーを有するC2 likeドメインはカルシウムイオンを結合しない。非典型PKCは1つのC1ドメインのみを有するが、ジアシアルグリセロール結合活性は失なわれている。すべてのPKCアイソザイムの触媒領域はATP結合ドメインとキナーゼドメインからなる。 例として、在来型PKCに共通する一次構造を示す: H2N – 偽基質領域 – C1A - C1B - C2ドメイン – ATP結合ドメイン (C3) – キナーゼドメイン (C4) - COOH 機能PKCのターゲット配列はAキナーゼのものに似ており、リン酸化を受けるセリン/スレオニン残基の近くに塩基性アミノ酸がある。基質にはMARCKS(Myristoylated alanine-rich C kinase substrate)タンパク質、MAPキナーゼ、転写因子阻害タンパク質であるIκB、ビタミンD3受容体(VDR)、Rafキナーゼ、カルパインや上皮成長因子受容体 (EGFR) があり、細胞内シグナル伝達において特に中心的な役割を担っていると考えられる。また、12-O-テトラデカノイルホルボール 13-アセタート (TPA) などの発がんプロモーターや抗がん剤として臨床試験が行われているブリオスタチン類の主要なターゲットとしても知られている。 PKCはがんやアルツハイマー病など様々な疾患に関与していることも明らかになっている。 Ca2+/カルモジュリン依存性タンパク質キナーゼEC 2.7.11.17。カルモジュリン(CaM)キナーゼとも呼ばれ、主にCa2+/カルモジュリン複合体により活性化される。活性化に関して「記憶作用」、つまり活性化反応が終わっても活性化状態が長続きする性質がある。次の2つのタイプがある:
構造と自己調節CaMキナーゼはN末端側の触媒ドメイン、調節ドメイン、および付随ドメインからなる。Ca2+/カルモジュリンがない場合には触媒ドメインは調節ドメイン(基質に似た配列を含む)による自己抑制を受けている。CaMキナーゼはいくつかの分子が会合してホモオリゴマーまたはヘテロオリゴマーになっている。Ca2+/カルモジュリンによって活性化されると、CaMキナーゼ分子は互いにリン酸化しあう。これには2つの効果がある:
MAPキナーゼ
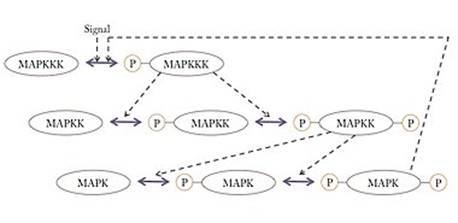
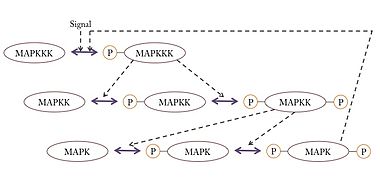
Mitogen-activated protein kinases(マイトジェン活性化プロテインキナーゼ、分裂促進因子活性化タンパク質キナーゼ;EC 2.7.11.24)の略。細胞をマイトジェン(細胞増殖促進物質の総称)で処理した場合に活性化したことからこの名がついた。MAPKKKK => MAPKKK => MAPKK => MAPK (これは一般的な表記法でそれぞれKはキナーゼを意味するが、実際には色々な種類がある)というカスケードを形成して順次活性化され、最終的に転写因子をリン酸化して細胞周期や増殖を制御する。 Mos/RafキナーゼRafはGTP結合型(活性型)のRas(がん遺伝子産物)をはじめとする低分子型GTP結合タンパク質やCキナーゼなどによって活性化され、下流のMEKキナーゼをリン酸化して活性化する。Mosは動物卵の減数分裂で特異的に発現し、その活性(下流のMEK-MAPK-p90Rskを含む)は減数分裂の進行及び減数第二分裂での分裂停止(ヒトデ等の無脊椎動物は減数分裂直後のG1期停止)に必須とされる。これらのキナーゼ自体も元来、原がん遺伝子(c-mos、c-raf)産物として同定されたものである。 cdc2細胞周期の分裂期の制御因子として、分裂酵母、カエル、ヒトデなどいくつかの真核生物から独立に発見された。(2001年のノーベル生理学・医学賞の受賞対象となった研究である。)制御の仕方は生物により異なるが、いずれもサイクリンとよばれるタンパク質と結合することや、それ自身がリン酸化されることによって活性を持ち、特定の基質をリン酸化することで分裂期の特徴的な現象(核膜崩壊、染色体凝集、紡錘体の形成など)を制御する。 チロシンキナーゼチロシンキナーゼ(あるいは蛋白質チロシンキナーゼ、Protein Tyrosine Kinase; PTK、EC 2.7.10.*)はタンパク質のチロシン残基を特異的にリン酸化する酵素である。多細胞生物のみに存在し、細胞の分化,増殖、接着、あるいは免疫反応などに関わるシグナル伝達に関与する。増殖因子が結合することによって活性化する受容体型と、増殖因子が結合しない非受容体型の2型に大別される。チロシンキナーゼが活性化されると、受容体自身、あるいは標的とするタンパクを特異的にリン酸化する。受容体自身の自己リン酸化により、このリン酸化部位を認識するさまざまなシグナル伝達因子が受容体に結合し、シグナル伝達が始まる。また標的タンパクのリン酸化により、細胞内のさまざまなタンパクが次々と活性化し、シグナル伝達が始まる。がんやアテローマ性動脈硬化症、乾癬などでは、過剰に活性化していることがある。 ヒトのチロシンキナーゼは100種類以上あると予想されている[1]が、その大半は機能が分かっていない。 受容体型チロシンキナーゼ細胞膜を膜貫する構造であり、細胞外に増殖因子の結合部位をもち、細胞質領域にチロシンキナーゼ活性部位をもつ。EC 2.7.10.1。増殖因子は哺乳動物では50種類以上が知られ、受容体型チロシンキナーゼは、この増殖因子の刺激を細胞内へのシグナルに変換し、細胞の分裂、分化、形態形成で重要な役割を演ずる。代表的なものを以下に挙げる。
構造受容体型チロシンキナーゼは、3つの領域からなる。増殖因子が結合する細胞外領域、細胞膜を貫通する疎水性膜貫領域、チロシンキナーゼ活性をもつ細胞内領域である。さらに細胞内領域は膜近傍領域、キナーゼ活性領域、C末端領域の3つに分けられる。インスリン受容体やインスリン様増殖因子のように、細胞外領域が分離独立し、ジスルフィド結合で受容体本体に結合する構造をとるものもある。膜貫領域は単一のαヘリックスからなる。 増殖因子が細胞外領域にある受容体に結合すると、受容体は活性化して細胞膜上を移動し、他の受容体に結合して二量体を形成する。同じ受容体同士が結合する(ホモダイマー)ことも、異なる受容体同士が結合する(ヘテロダイマー)こともある。 制御増殖因子の結合により2つの反応が起きる:
リン酸化を受けるアミノ酸がキナーゼドメインにいくつかある場合、リン酸化されたアミノ酸が多いほどキナーゼ活性は上昇する。この場合、最初のリン酸化はシス自己リン酸化といい、これでキナーゼは「オフ」から「スタンバイ」状態に切り替わる。 非受容体型チロシンキナーゼ代表的な構造は、細胞外領域をもたず、細胞内で細胞膜に結合し、細胞内の末端側にチロシンキナーゼ部位をもつ構造である。免疫グロブリンやサイトカイン等の結合部位を持ち,これらの刺激により活性化する。
ヒスチジンキナーゼヒスチジン特異的キナーゼ(EC 2.7.13.x)は構造的に他のキナーゼと異なりGHKL型kinase/ATPase スーパーファミリーに分類される。ヒスチジンキナーゼは原核生物のほか菌類と植物に見られ、「2成分系シグナル伝達」で機能する。ATPのリン酸基はまずキナーゼ分子のヒスチジン残基(イミダゾール環窒素原子)に移され、その後他のタンパク質(同じキナーゼ分子内のばあいもある)の「レシーバードメイン」にあるアスパラギン酸残基に移される(この段階ではATPのエネルギーは必要ない)。このようなリン酸の受け渡しがさらに繰り返されるばあいもある。その結果として転写制御などが行われる。リン酸化アスパラギン酸が活性型としてシグナルを伝達する。微生物では細胞外の状態(浸透圧、酸素や栄養分など)を感知するいろいろな受容体、植物では植物ホルモン(サイトカイニン、エチレン)受容体や光受容体などが知られる。 動物にあるピルビン酸脱水素酵素キナーゼは構造的にヒスチジンキナーゼに類似しているGHKL型kinaseであるが、ヒスチジンを介した2成分系シグナル伝達は行わず、ピルビン酸脱水素酵素のセリン残基を直接リン酸化する。 アスパラギン酸/グルタミン酸キナーゼEC 2.7.12.x 脚注1. ^ Plowman GD, Sudarsanam S, Bingham J, et al. "Review. The protein kinases of Caenorhabditis elegans: a model for signal transduction in multicellular organisms." Proceedings of the National Academy of Sciences of the United States of America 1999;96:13603-13610. PMID 10570119 関連項目外部リンク
<img src="//ja.wikipedia.org/wiki/Special:CentralAutoLogin/start?type=1x1" alt="" title="" width="1" height="1" style="border: none; position: absolute;" /> 「https://ja.wikipedia.org/w/index.php?title=プロテインキナーゼ&oldid=67323040」から取得 カテゴリ:
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
プロテアーゼTEVプロテアーゼの構造。基質とのペプチド結合を黒、触媒残基を赤で表す。(PDB 1LVB) プロテアーゼ(Protease、EC 3.4群)とはペプチド結合加水分解酵素の総称で、プロテイナーゼ(proteinase)とも呼ばれる。広義のペプチダーゼ(Peptidase)のこと。タンパク質やポリペプチドの加水分解酵素で、それらを加水分解して異化する。収斂進化により、全く異なる触媒機能を持つプロテアーゼが似たような働きを持つ。プロテアーゼは動物、植物、バクテリア、古細菌、ウイルスなどにある。ヒトでは小腸上皮細胞から分泌する。 機能アミノ酸がペプチド結合によって鎖状に連結したペプチド(一般に100残基未満、比較的分子量が小さい)やタンパク質(一般に100残基以上、比較的分子量が大きい)のペプチド結合を加水分解する酵素で、様々な種類のものが、生理的役割として、栄養吸収、タンパク質の廃棄とリサイクル、生体防御、活性の調節、などの幅広い分野で働いている。 分類プロテアーゼの分類は歴史的に様々な変遷を経ている。今日では切断位置によるエキソペプチダーゼないしはエンドペプチダーゼの分類が広く用いられる[1]。
古くはタンパク質を基質にするものを「プロテイナーゼ」、合成ペプチドを基質にするものを「ペプチダーゼ」としていたが、分類の境界が不明瞭である。現在のエンドペプチダーゼには従来プロテイナーゼに分類されていた大半の酵素が含まれ、エキソペプチダーゼには従来ペプチダーゼに分類されていたものの多くが属する。 エキソペプチダーゼのうち、基質のN末端から1残基ずつ切断する酵素をアミノペプチダーゼ、C末端側から1残基ずつ切断する酵素をカルボキシペプチダーゼと呼ぶ。 ペプチダーゼのうち、アルカリ性領域に至適pHを持つものは、洗剤補助剤として日用品に利用されるため、アルカリ(性)プロテアーゼとよばれることがある。 基質特異性プロテアーゼには切断する配列をあまり選ばない(基質特異性が低い)ものや、特定のタンパク質・ペプチドの特定の部位だけを特異的に切断するという切断する配列に対する高度な選択性を持つ(基質特異性が高い)タイプのものがある。ペプシン(pepsin)やキモトリプシン(chymotrypsin)などが前者の、ケキシン(Kexin)やフューリン(Furin)のようなプロセッシングプロテアーゼ、Xa因子のような血液凝固因子などが後者の例として典型的なものである。前述のHIVプロテアーゼはその基質特異性故にHIV治療の重要な標的となり、阻害剤による治療が大きな成果を上げている。 植物植物には、プロテアーゼを豊富に含むものがある。
菌類
細菌類納豆菌 - ナットウキナーゼを含む。脚注1. ^ a b 「プロテアーゼ」、『岩波生物学辞典』第4版、岩波書店、1996年。 関連項目 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
プロテインキナーゼプロテインキナーゼ (Protein kinase; プロテインカイネース) は、タンパク質分子にリン酸基を付加する(リン酸化する)酵素である。タンパク質キナーゼあるいは英語風にプロテインカイネースとも呼ぶ。キナーゼ(リン酸基転移酵素)の中でタンパク質をリン酸化するキナーゼをプロテインキナーゼと呼ぶが、このプロテインキナーゼのことを特にキナーゼと呼ぶことが多い(本記事では以後単にキナーゼという)。 概要細胞は、その機能を維持するため、細胞内のタンパク質をリン酸化、脱リン酸化する反応を繰り返している。このリン酸化によってタンパク質は酵素活性、細胞内での局在や他のタンパク質との会合状態を変化させる。細胞内の30%ものタンパク質がキナーゼによる変化を受け、細胞内における様々なシグナル伝達や代謝の調節因子として機能している。キナーゼ遺伝子はヒトゲノム中に約500種類があり、また真核生物の全遺伝子の約2%を占める。 キナーゼは、ATPのリン酸基をアミノ酸残基にあるヒドロキシ基に移動させ、共有結合させる活性を有する。キナーゼはアミノ酸のうち、主にセリン、スレオニン、チロシン残基をリン酸化させるが、キナーゼがリン酸化するアミノ酸の99%以上はセリン、スレオニンである(セリン/スレオニンキナーゼ)。しかし、0.1%に満たないチロシンのリン酸化(チロシンキナーゼ)の方が生物学的に重要なケースが多い。これら3種類すべてに反応するものや、またこのほかに微生物や植物ではヒスチジンのイミダゾール環窒素原子に反応するもの(ヒスチジンキナーゼ;EC 2.7.13に含まれる)もある。 キナーゼの活性は精密に調節されており、キナーゼ自身もリン酸化によってオン・オフ調節を受ける。これは他のキナーゼのみならず、自分自身によって行われることもあり、“自己リン酸化”という。これらの調節は他の活性化(または抑制)タンパク質や低分子化合物の結合、細胞内での局在変化などによって起きる。 キナーゼの機能異常は病気の原因になることも多い。特にがんに関して詳細な研究が行われており、キナーゼはがん細胞の増殖、移動、浸潤やアポトーシス(細胞死)の調節に関与する。特定のキナーゼを阻害することによって治療に役立てる薬物が開発されており、中にはゲフィチニブ(イレッサ®)やイマチニブ(グリベック®)のように、すでに臨床的に用いられているものもある。 セリン/スレオニンキナーゼセリン/スレオニンキナーゼ(Ser/Thr kinase; 読み:セリン/スレオニン カイネース、EC 2.7.11.*)はセリンまたはスレオニンのヒドロキシ基をリン酸化する。これらは によって調節される。これらのキナーゼの特異性は特定のアミノ酸配列に基づくものではなく、リン酸化される基質はキーとなる数個のアミノ酸(疎水結合やイオン結合による)でキナーゼと結合するから、普通、キナーゼはある性質を共有する「基質ファミリー」全体に対して特異的である。ほとんどのキナーゼは、本当の基質のようにキナーゼに結合するがリン酸化を受けるアミノ酸を欠くような「擬似基質」によって阻害される。擬似基質が取り除かれるとキナーゼは機能を取り戻す。これらのキナーゼの触媒部位は高度に保存されている。 セリン/スレオニンキナーゼには以前は一部を除いて独自のEC番号はなく、"EC 2.7.1.37"を用いていた。国際生化学分子生物学連合IUBMBの命名委員会(NC-IUBMB)によって見直しされ、2005年にそれぞれ独自のEC番号が割り当てられた。 ホスホリラーゼキナーゼホスホリラーゼキナーゼ(EC 2.7.11.19)は初めて発見された(1959年、エドヴィン・クレープスら)セリン/スレオニンキナーゼである。グリコーゲンホスホリラーゼ(グリコーゲンを加リン酸分解する酵素)を活性化する。 プロテインキナーゼAプロテインキナーゼA(AキナーゼまたはPKA、EC 2.7.11.11)は2つのドメインからなり、小ドメインはβシートを、大ドメインはαヘリックスを含む。基質とATPの結合部位は2つのドメインの間隙にある。ATPと基質が結合すると、2つのドメインは互いに回転するように動き、ATPの末端リン酸基と基質のターゲットアミノ酸が近寄って反応が起きやすい位置となる。制御[Aキナーゼは細胞内でcAMPによる調節を受け、グリコーゲン、糖、脂質の代謝の調節など、いくつかの機能を有する。cAMPがないときは4量体(調節サブユニット2個と触媒サブユニット2個:R2C2)からなり、調節サブユニットが触媒サブユニットの活性中心を封鎖している。cAMPが調節サブユニットに結合すると、2個のRCに解離し、これが活性を有する。また触媒サブユニット自体もリン酸化によって調節される。Aキナーゼは次のようなフィードバック機構によってダウンレギュレーションされる:Aキナーゼによって活性化される基質の1つにホスホジエステラーゼがあり、これはcAMPをAMPに変換し、cAMP量を下げてAキナーゼの活性を低下させる。グリコーゲンの分解においては、Aキナーゼがホスホリラーゼキナーゼをリン酸化して活性化し、さらにこれがグリコーゲンホスホリラーゼをリン酸化して活性化するのである。 プロテインキナーゼC概要
プロテインキナーゼC(プロテインキナーゼ・シー)あるいはPKC、Cキナーゼ (EC 2.7.11.13) は少なくとも10種類以上のアイソザイムから構成されるタンパク質ファミリーである。PKCは基質に存在するセリンおよびスレオニン残基のヒドロキシル基をリン酸化する。1977年に西塚泰美らによって発見された。PKCは、その構造、活性化機構、生理機能によって、在来型(conventionalあるいはclassical:α、βI、βII、γ)、新型(novel:δ、ε、η、θ)、非典型(atypical:ζ、λ/ι)の3つのサブファミリーに分類される。在来型PKCは主にカルシウムイオン(Ca2+)、ジアシルグリセロール (DAG, DG)、あるいはホスファチジルセリン (PS) などのリン脂質によって活性化される。新型PKCはカルシウムイオン結合活性を失っており、ジアシルグリセロールによる活性化を受ける。ジアシルグリセロールは細胞膜、核膜の構成成分であるホスファチジルイノシトール (PI) からホスホリパーゼCによって産生されるため、在来型・新型PKCはシグナル伝達経路においてホスホリパーゼCの下流に位置する。一方、非典型PKCはカルシムイオンおよびジアシルグリセロール結合活性を持たない。在来型PKCの1種であるCαを日本では特にCキナーゼと呼ぶことがある。 アイソザイム
構造と制御在来型PKCは、N末端側の調節領域とC末端側の触媒領域からなる。通常、PKCは調節領域に存在する偽基質領域による自己阻害作用のため不活性化状態で細胞質に存在し、セカンドメッセンジャー(カルシウムやジアシルグリセロール)によって活性化されると、細胞質に移行し基質をリン酸化する。 在来型PKCの調節領域には、連続した2つのC1ドメイン(ジアシルグリセロール結合ドメイン:C1AおよびC1B)とC2ドメイン(カルシウムイオン結合ドメイン)が存在する。新型PKCは、在来型と同様に連続した2つのC1ドメインを有しているが、在来型PKCのC2ドメインとホモロジーを有するC2 likeドメインはカルシウムイオンを結合しない。非典型PKCは1つのC1ドメインのみを有するが、ジアシアルグリセロール結合活性は失なわれている。すべてのPKCアイソザイムの触媒領域はATP結合ドメインとキナーゼドメインからなる。 例として、在来型PKCに共通する一次構造を示す: H2N – 偽基質領域 – C1A - C1B - C2ドメイン – ATP結合ドメイン (C3) – キナーゼドメイン (C4) - COOH 機能PKCのターゲット配列はAキナーゼのものに似ており、リン酸化を受けるセリン/スレオニン残基の近くに塩基性アミノ酸がある。基質にはMARCKS(Myristoylated alanine-rich C kinase substrate)タンパク質、MAPキナーゼ、転写因子阻害タンパク質であるIκB、ビタミンD3受容体(VDR)、Rafキナーゼ、カルパインや上皮成長因子受容体 (EGFR) があり、細胞内シグナル伝達において特に中心的な役割を担っていると考えられる。また、12-O-テトラデカノイルホルボール 13-アセタート (TPA) などの発がんプロモーターや抗がん剤として臨床試験が行われているブリオスタチン類の主要なターゲットとしても知られている。 PKCはがんやアルツハイマー病など様々な疾患に関与していることも明らかになっている。 Ca2+/カルモジュリン依存性タンパク質キナーゼEC 2.7.11.17。カルモジュリン(CaM)キナーゼとも呼ばれ、主にCa2+/カルモジュリン複合体により活性化される。活性化に関して「記憶作用」、つまり活性化反応が終わっても活性化状態が長続きする性質がある。次の2つのタイプがある:
構造と自己調節CaMキナーゼはN末端側の触媒ドメイン、調節ドメイン、および付随ドメインからなる。Ca2+/カルモジュリンがない場合には触媒ドメインは調節ドメイン(基質に似た配列を含む)による自己抑制を受けている。CaMキナーゼはいくつかの分子が会合してホモオリゴマーまたはヘテロオリゴマーになっている。Ca2+/カルモジュリンによって活性化されると、CaMキナーゼ分子は互いにリン酸化しあう。これには2つの効果がある:
MAPキナーゼ
Mitogen-activated protein kinases(マイトジェン活性化プロテインキナーゼ、分裂促進因子活性化タンパク質キナーゼ;EC 2.7.11.24)の略。細胞をマイトジェン(細胞増殖促進物質の総称)で処理した場合に活性化したことからこの名がついた。MAPKKKK => MAPKKK => MAPKK => MAPK (これは一般的な表記法でそれぞれKはキナーゼを意味するが、実際には色々な種類がある)というカスケードを形成して順次活性化され、最終的に転写因子をリン酸化して細胞周期や増殖を制御する。 Mos/RafキナーゼRafはGTP結合型(活性型)のRas(がん遺伝子産物)をはじめとする低分子型GTP結合タンパク質やCキナーゼなどによって活性化され、下流のMEKキナーゼをリン酸化して活性化する。Mosは動物卵の減数分裂で特異的に発現し、その活性(下流のMEK-MAPK-p90Rskを含む)は減数分裂の進行及び減数第二分裂での分裂停止(ヒトデ等の無脊椎動物は減数分裂直後のG1期停止)に必須とされる。これらのキナーゼ自体も元来、原がん遺伝子(c-mos、c-raf)産物として同定されたものである。 cdc2細胞周期の分裂期の制御因子として、分裂酵母、カエル、ヒトデなどいくつかの真核生物から独立に発見された。(2001年のノーベル生理学・医学賞の受賞対象となった研究である。)制御の仕方は生物により異なるが、いずれもサイクリンとよばれるタンパク質と結合することや、それ自身がリン酸化されることによって活性を持ち、特定の基質をリン酸化することで分裂期の特徴的な現象(核膜崩壊、染色体凝集、紡錘体の形成など)を制御する。 チロシンキナーゼチロシンキナーゼ(あるいは蛋白質チロシンキナーゼ、Protein Tyrosine Kinase; PTK、EC 2.7.10.*)はタンパク質のチロシン残基を特異的にリン酸化する酵素である。多細胞生物のみに存在し、細胞の分化,増殖、接着、あるいは免疫反応などに関わるシグナル伝達に関与する。増殖因子が結合することによって活性化する受容体型と、増殖因子が結合しない非受容体型の2型に大別される。チロシンキナーゼが活性化されると、受容体自身、あるいは標的とするタンパクを特異的にリン酸化する。受容体自身の自己リン酸化により、このリン酸化部位を認識するさまざまなシグナル伝達因子が受容体に結合し、シグナル伝達が始まる。また標的タンパクのリン酸化により、細胞内のさまざまなタンパクが次々と活性化し、シグナル伝達が始まる。がんやアテローマ性動脈硬化症、乾癬などでは、過剰に活性化していることがある。 ヒトのチロシンキナーゼは100種類以上あると予想されている[1]が、その大半は機能が分かっていない。 受容体型チロシンキナーゼ細胞膜を膜貫する構造であり、細胞外に増殖因子の結合部位をもち、細胞質領域にチロシンキナーゼ活性部位をもつ。EC 2.7.10.1。増殖因子は哺乳動物では50種類以上が知られ、受容体型チロシンキナーゼは、この増殖因子の刺激を細胞内へのシグナルに変換し、細胞の分裂、分化、形態形成で重要な役割を演ずる。代表的なものを以下に挙げる。
構造受容体型チロシンキナーゼは、3つの領域からなる。増殖因子が結合する細胞外領域、細胞膜を貫通する疎水性膜貫領域、チロシンキナーゼ活性をもつ細胞内領域である。さらに細胞内領域は膜近傍領域、キナーゼ活性領域、C末端領域の3つに分けられる。インスリン受容体やインスリン様増殖因子のように、細胞外領域が分離独立し、ジスルフィド結合で受容体本体に結合する構造をとるものもある。膜貫領域は単一のαヘリックスからなる。 増殖因子が細胞外領域にある受容体に結合すると、受容体は活性化して細胞膜上を移動し、他の受容体に結合して二量体を形成する。同じ受容体同士が結合する(ホモダイマー)ことも、異なる受容体同士が結合する(ヘテロダイマー)こともある。 制御増殖因子の結合により2つの反応が起きる:
リン酸化を受けるアミノ酸がキナーゼドメインにいくつかある場合、リン酸化されたアミノ酸が多いほどキナーゼ活性は上昇する。この場合、最初のリン酸化はシス自己リン酸化といい、これでキナーゼは「オフ」から「スタンバイ」状態に切り替わる。 非受容体型チロシンキナーゼ代表的な構造は、細胞外領域をもたず、細胞内で細胞膜に結合し、細胞内の末端側にチロシンキナーゼ部位をもつ構造である。免疫グロブリンやサイトカイン等の結合部位を持ち,これらの刺激により活性化する。
ヒスチジンキナーゼヒスチジン特異的キナーゼ(EC 2.7.13.x)は構造的に他のキナーゼと異なりGHKL型kinase/ATPase スーパーファミリーに分類される。ヒスチジンキナーゼは原核生物のほか菌類と植物に見られ、「2成分系シグナル伝達」で機能する。ATPのリン酸基はまずキナーゼ分子のヒスチジン残基(イミダゾール環窒素原子)に移され、その後他のタンパク質(同じキナーゼ分子内のばあいもある)の「レシーバードメイン」にあるアスパラギン酸残基に移される(この段階ではATPのエネルギーは必要ない)。このようなリン酸の受け渡しがさらに繰り返されるばあいもある。その結果として転写制御などが行われる。リン酸化アスパラギン酸が活性型としてシグナルを伝達する。微生物では細胞外の状態(浸透圧、酸素や栄養分など)を感知するいろいろな受容体、植物では植物ホルモン(サイトカイニン、エチレン)受容体や光受容体などが知られる。 動物にあるピルビン酸脱水素酵素キナーゼは構造的にヒスチジンキナーゼに類似しているGHKL型kinaseであるが、ヒスチジンを介した2成分系シグナル伝達は行わず、ピルビン酸脱水素酵素のセリン残基を直接リン酸化する。 アスパラギン酸/グルタミン酸キナーゼEC 2.7.12.x 脚注1. ^ Plowman GD, Sudarsanam S, Bingham J, et al. "Review. The protein kinases of Caenorhabditis elegans: a model for signal transduction in multicellular organisms." Proceedings of the National Academy of Sciences of the United States of America 1999;96:13603-13610. PMID 10570119 関連項目外部リンク
<img src="//ja.wikipedia.org/wiki/Special:CentralAutoLogin/start?type=1x1" alt="" title="" width="1" height="1" style="border: none; position: absolute;" /> 「https://ja.wikipedia.org/w/index.php?title=プロテインキナーゼ&oldid=67323040」から取得 カテゴリ:
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
ち チアミナーゼ チアミナーゼ チアミナーゼ(Thiaminase)は、チアミンを2つの分子に代謝する酵素である。かつてはアノイリナーゼ(Aneurinase)と言った[1]。 次の2つの型がある[2]。
源チアミナーゼは、次のような源に含まれている。
効果植物、魚、細菌、昆虫等に対する生理学的な意味は分かっていない。 1941年に、毛皮採取用の養殖のキツネにコイのような川魚の内臓を生で食べさせていたところ、ニューロパチーの発症(狐脚気)の原因になっていることが初めて報告された[11]。 また、チアミナーゼの含まれた食品を食べることがウシの大脳皮質壊死症やヒツジの灰白脳軟化症の病因になるということも知られていた[13][14]。 かつては、ヒラマサがある期間アンチョビのみを食べるため、養殖漁業で経済的な被害の原因となったこともあった。同じ問題は、自然界の食物連鎖システムの観点でも研究されている[15]。 カイコAnaphe venataの幼虫はナイジェリアの熱帯雨林で重要なタンパク質源となっており、含まれる耐熱チアミナーゼが急性の小脳失調の原因となっている[16]。 1860年から61年にかけて、バーク・ウィルズ探検隊はオーストラリアを南北に横断した最初のヨーロッパ人となったが、帰路の途中、彼らはチアミンの少ない食事の中、主に生のデンジソウを食糧にしており、脚気になって死亡した[2]。 出典1. ^ Fujita A, Nose Y, Kozuka S et al. (1952). “Studies on thiaminase”. J.Biol.Chem. 196 (1): 289–295. PMID 12980969. 2. ^ a b Thiaminases 3. ^ a b c ビタミンB1解説 - 「健康食品」の安全性・有効性情報(国立健康・栄養研究所) 4. ^ スギナ(ツクシ/モンケイ) - 「健康食品」の安全性・有効性情報(国立健康・栄養研究所) 5. ^ NcCleary BV and Chick BF. (1977). “The purification and properties of a thiaminaseI from Nardoo (Marsilea drummondii)”. Phytochemistry 16: 207–213. doi:10.1016/S0031-9422(00)86787-4. 6. ^ Boś M, Kozik A (2000). “Some molecular and enzymatic properties of a homogeneous preparation of thiaminase I purified from carp liver”. J Protein Chem 19 (2): 75–84. doi:10.1023/A:1007043530616. PMID 10945431. 7. ^ http://ci.nii.ac.jp/naid/110002871209 8. ^ Wittliff JL and Airth RL. (1968). “The extracellular thiaminase I of Bacillus thiaminolyticus I. Purification and physicochemical properties”. Biochemistry 7 (2): 736–44. doi:10.1021/bi00842a032. PMID 4966932. 9. ^ Nakatsuka T, Suzuki K, Nakano Y, Kitaoka S. (1988). “Physicochemical properties of intracellular thiaminase II of Bacillus aneurinolyticus”. Vitamins (Japan) 62: 15–22. 10. ^ Toms A, Haas A, Park J, Begley T, Ealick S (2005). “Structural characterization of the regulatory proteins TenA and TenI from Bacillus subtilis and identification of TenA as a thiaminase II”. Biochemistry 44 (7): 2319–29. doi:10.1021/bi0478648. PMID 15709744. 11. ^ a b http://ir.jikei.ac.jp/bitstream/10328/3445/3/TK_igaku_164.pdf 12. ^ Nishimune T, Watanabe Y, Okazaki H, Akai H. (2000). “Thiamin is decomposed due to Anaphe spp. entomophagy in seasonal ataxia patients in Nigeria”. J.Nutr. 130: 1625–28. 13. ^ Ramos J, Marca C, Loste A, García de Jalón J, Fernández A, Cubel T (2003). “Biochemical changes in apparently normal sheep from flocks affected by polioencephalomalacia”. Vet Res Commun 27 (2): 111–24. doi:10.1023/A:1022807119539. PMID 12718505. 14. ^ Evans WC. (1975). “Thiaminases and their effects on animals”. Vitamins and Hormones 33: 467–504. doi:10.1016/S0083-6729(08)60970-X. PMID 779253. 15. ^ Fisher JP, Brown SB, Wooster GW and Bowser PR. (1998). “Maternal blood, egg and larval thiamin levels correlate with larval survival in landlocked Atlantic salmon”. J.Nutr. 128 (12): 2456–66. PMID 9868194. 16. ^ Adamolekun B, Adamolekun WE, Sonibare AD and Sofowora G. (1944). “A double-blind, placebo-controlled study of the efficacy of thiamin hydrochloride in a seasonal ataxia in Nigerians”. Neurology 44 (3 Pt 1): 549–51. PMID 8145931. 外部リンク |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
チオキナーゼ チオキナーゼ(Thiokinase)は、補酵素Aのチオエステルを合成するリガーゼである。EC番号では、EC 6.2に分類されるが、名前には「チオキナーゼ」という言葉が含まれないことが多い。 次の種類に分類される。 酢酸CoAリガーゼ(EC 6.2.1.13) 酪酸CoAリガーゼ(EC 6.2.1.2) クエン酸CoAリガーゼ(EC 6.2.1.18) マレイン酸CoAリガーゼ(EC 6.2.1.9) コハク酸CoAリガーゼ(EC 6.2.1.5) スクシニルCoAシンテターゼ(EC 6.2.1.4) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
チオラーゼ アセチルCoAアセチルトランスフェラーゼ1 (アセトアセチルCoAチオラーゼ)
チオラーゼ (Thiolase) は、別名をアセチルCoAアセチルトランスフェラーゼ(Acetyl-Coenzyme A acetyltransferase)、アセトアセチルCoAチオラーゼ、アセチルCoA C-アセチルトランスフェラーゼという酵素で、EC番号2.3.1.9。アセチルCoA二分子からアセトアセチルCoA二分子と補酵素Aを生成する反応を触媒する、メバロン酸経路の酵素の一つ。ヒトの場合第6染色体のq25.3-q26に存在するACAT2及び第11染色体のq22.3-23.1に存在するACAT1が知られる。 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
シトクロムP450
シトクロムP450(英語: Cytochrome P450)は特定の酸化還元酵素ファミリーに属する酵素の総称である。単にP450あるいはCYP(シップ)と呼ばれることがある。様々な基質を酸化し、多くの役割を果たす。肝臓において解毒を行う酵素として知られているとともに、ステロイドホルモンの生合成、脂肪酸の代謝や植物の二次代謝など、生物の正常活動に必要な様々な反応に関与している。NADPHなどの電子供与体と酸素を用いて基質を酸化することも共通である。シトクロムP450は細胞内の小胞体に多く、一部はミトコンドリアに存在する。動物では肝臓に多く、特によく研究されている。 ゲノムプロジェクトによって一部の細菌を除く大部分の生物(大腸菌には見つかっていない)にその遺伝子があることが明らかにされた。例えばヒトには57個の遺伝子がある。また、植物のシトクロムP450は基質特異性が高く、多くの種類が存在するとされている[1]、例えばイネにおいては候補遺伝子が400以上も発見されている。しかし、機能がわかっているものは少ない。 構造すべてのシトクロムP450は約500アミノ酸残基からなり、活性部位にヘムを持つ。保存されたシステイン残基と水分子がヘムの鉄原子にリガンドとして配位する。基質が酵素に結合すると、水がはずれ酸素が結合できるようになる。シトクロムとは以上のような構造的特徴、および反応過程で鉄が酸化・還元を受ける点で類似性があるが、シトクロムは一般に酵素でなく電子伝達タンパク質であって機能が異なる。 一酸化炭素が還元型の酵素の活性部位の鉄原子に結合すると、450ナノメートル(可視光領域)の波長を持つ電磁波に対し吸収極大を示すので、ピグメント(色素)450という意味で大村恒雄と佐藤了により1964年に命名された[2]。 分類・命名シトクロムP450はアミノ酸配列の相同性に基づいて分類され、40%以上相同のものをファミリー、55%以上相同のものをサブファミリーとして分類する。 たとえば「CYP1A1」というように表記し、最初の数字1は「ファミリー1」、Aは「サブファミリーA」、最後の数字1が特定の蛋白質(遺伝子はCYP1A1と斜体で表記する)を示す(別の生物種でも明らかに対応する場合には同じ名にする)。
機能異物代謝(解毒作用など)さまざまなシトクロムP450の基質は脂溶性で、蓄積すると毒になるものが多い。たとえば、ポリ塩化ビフェニル(PCB)、フェノバルビタールをはじめとする薬物、ステロイドなどである。これら基質の多くにはシトクロムP450の発現を誘導する性質もある。シトクロムP450はこれらの分子を水酸化して、排出されやすい水溶性の物質に変える。一方、ベンゾピレンなどの発癌物質では逆にシトクロムP450による水酸化で発癌性が生じることが明らかにされている。 薬物相互作用「薬物相互作用」も参照 カルシウム拮抗剤などでグレープフルーツジュースとの併用により副作用が増強することがある。これはCYP3A4の活性が阻害され薬物の代謝が遅くなるためとされ酵素阻害と呼ばれる。逆にセイヨウオトギリはCYP3A4を誘導し薬物の代謝を速め酵素誘導と呼ばれる。このほかにもシトクロムP450が関係した薬物の相互作用がありうるので注意が必要である。その他、CYP2D6などの遺伝的多型により各種薬物の代謝速度に個人差が現れることが知られている。 コレステロール生合成などCYP51は現在シトクロムP450の存在が知られるすべての生物種に見つかっており最も基本的な分子種と考えられている。これは多くの生物でステロイド生合成の基本となるステロール14α-脱メチル化酵素活性を有しており、特に真菌では生存に必要なエルゴステロールの合成に関与するため、アゾール系などのシトクロムP450阻害剤が殺菌剤・抗真菌薬として用いられる。 動物のステロイドホルモン合成においてもエストロゲン合成に関わるCYP19(アロマターゼ)など重要なものがある。またプロスタサイクリン(プロスタグランジンPGI2)などの合成にも関与するものがある。 転写調節CYP1-CYP4はそれぞれ薬物代謝に関与する(上記参照)が、これらの酵素の誘導は薬物がリガンドとしてある受容体に結合することにより行われる。関与する受容体は以下の通りである。
これらの受容体がリガンド結合後、DNA上のプロモーター領域に結合して各CYP遺伝子の転写亢進を行う。 出典
脚注1. ^ 水谷正治、『シトクロムP450の多様性と植物の化学進化』 Regulation of Plant Growth & Development 40(1), 67-82, 2005-05-27, NAID 10015669125 2. ^ Omura, T.; Sato, R. (1964). “The carbon monoxide-binding pigment of liver microsomes: I. Evidence for its hemoprotein nature”. J. Biol. Chem. 239: 2370-2378. PMID 14209971. 関連項目
外部リンク
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
チマーゼ チマーゼ(Zymase)は、スクロースをエタノールと二酸化炭素に発酵させる酵素複合体である。酵母が天然に生成する。 チマーゼは1897年にドイツの化学者エドゥアルト・ブフナーによって酵母の細胞から初めて単離された。彼は無細胞の環境で砂糖を発酵させ、1907年にノーベル化学賞を受賞した。 チマーゼは、アミラーゼ、ペプチダーゼ、リパーゼ等を含むサプリメントのブランド名にもなっている。これは消化酵素が十分分泌されない人の消化を助けるために販売されている。 無細胞での発酵実験 ブフナーがノーベル化学賞を受賞した実験で、彼は酵母細胞を含まない酵母抽出物を作り、この「絞り汁」がスクロースを発酵させられることを示した。この実験は、生きた酵母細胞が発酵に不必要なことを示し、生気論に打撃を与えた。無細胞抽出物は、乾燥酵母細胞と石英、珪藻土を混合し、すり鉢とすりこぎで酵母細胞を粉砕することで調製された。酵母細胞の内容物が流れ出るため、この混合物は湿り気を帯びた。混合物を絞り、グルコース、フルクトース、マルトースを加えると、時々二酸化炭素の発生が見られた。顕微鏡での観察により、抽出液中に生きた酵母細胞は含まれていないことが分かった。 興味深いことに、ブフナーは酵母細胞の内部で発酵が起こっているという真実には至らずに、スクロースを発酵させるため、酵母が細胞外に酵素を分泌しているという仮説を考えた。 1905年、イギリスの化学者アーサー・ハーデンはチマーゼを透析可能性により2つのグループに分類した。 科学史家の中には[1]、エドゥアルト・ブフナーは1897年の論文で単に1857年にアントワーヌ・ベシャンが行っていた実験を繰り返したに過ぎないと主張する者もいる。しかしベシャンは、酵母細胞なしで、彼が「チマーゼ」と呼ぶものだけでは、スクロースの反転は起こるが、アルコール発酵は起こらないとはっきり述べているのに対し、ブフナーは酵母のチマーゼだけでアルコール発酵を起こしている[2]。K.L. Manchesterによると[3]、ベシャンが「チマーゼ」と呼んでいたものは実際にはサッカラーゼであった。 関連項目 アルコールデヒドロゲナーゼ アルコール発酵 出典 ^ " Our textbooks, however, erroneously tell us that Buchner was the first to extract an enzyme from yeast, and call it zymase, a 'breakthrough' that was achieved in 1897, some 35 years after Bechamp's experiments ! " (Milton Wainwright, " Early history of microbiolgy ", Advances in applied microbiology, vol. 52, 2003, pp. 333-355, partly available on Google Books, esp. pp. 341-342.) ^ Antoine Béchamp, Les microzymas, Paris, 1883 (repr. Paris, 1990), pp. 286-288 ^ Keith L. Manchester : " Antoine Béchamp: père de la biologie. Oui ou non? ", Endeavour, Vol. 25, n° 2, 1 juny 2001, pp. 68-73; Keith L. Manchester : " Louis Pasteur, fermentation, and a rival ", South African Journal of Science, vol. 103 (2007), online. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
DNAグリコシラーゼDNAグリコシラーゼ(DNA glycosylase、EC 3.2.2.3)は、DNAのN-グリコシド結合を加水分解する酵素の総称で、塩基除去修復において傷害のある塩基をDNAから取り除く役割を担う。チミンDNAグルコシラーゼ、ウラシルDNAグルコシラーゼ、オキソグアニングルコシラーゼなど、傷害塩基の種類によってさまざまなものが存在する。反応の結果生じた塩基の無い部位(AP site)は、APエンドヌクレアーゼ、DNAリガーゼ等の塩基除去修復経路の下流の酵素によって処理される。 ウラシルDNAグルコシラーゼは、PCR産物間のコンタミネーションの防止のためにも使われている[1]。この他、ヒトの解糖系での反応を触媒する酵素の1つで、4量体で活性を示すグリセルアルデヒド-3-リン酸デヒドロゲナーゼの単量体が、ヒトのウラシルDNAグルコシラーゼと同じ物であることが判明した[2]。 出典2. ^ 『A human nuclear uracil DNA glycosylase is the 37-kDa subunit of glyceroaldehyde-3-phospholate dehydrogenase.』 参考文献· IUBMB entry for 3.2.2.3(英語) · BRENDA references for 3.2.2.3 (英語) · PubMed references for 3.2.2.3(英語) · PubMed Central references for 3.2.2.3(英語) · Google Scholar references for 3.2.2.3(英語) 関連項目]· 加水分解酵素 外部リンク· IUBMB entry for 3.2.2.3(英語) · KEGG entry for 3.2.2.3(英語) · BRENDA entry for 3.2.2.3(英語) · NiceZyme view of 3.2.2.3(英語) · EC2PDB: PDB structures for 3.2.2.3(英語) · PRIAM entry for 3.2.2.3(英語) · PUMA2 entry for 3.2.2.3(英語) · IntEnz: Integrated Enzyme entry for 3.2.2.3(英語) · MetaCyc entry for 3.2.2.3(英語) · Atomic-resolution structures of enzymes belonging to this class(英語) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
チロシナーゼ チロシナーゼ (tyrosinase) は以下の酵素の別名である。 モノフェノールモノオキシゲナーゼ EC 1.14.18.1 - メラニン合成に関わるのはこの酵素である。 カテコールオキシダーゼ EC 1.10.3.1 チロシンフェノールリアーゼ(β-チロシナーゼ) EC 4.1.99.2 L-ドーパクロムイソメラーゼ(チロシナーゼ関連タンパク質2) EC 5.3.3.12 チロシナーゼはモノフェノール類を酸化し、ラッカーゼはジフェノール類を酸化するとして分類されていたが、両酵素がモノフェノールもジフェノールも酸化する能力があるなど曖昧な点が多く、現在では総称としてフェノールオキシダーゼと呼ばれることが多い。 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
プロテインキナーゼ |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
て デオキシリボヌクレアーゼデオキシリボヌクレアーゼ (deoxyribonuclease, DNase) はデオキシリボ核酸のホスホジエステル結合を切断してオリゴヌクレオチドないしモノヌクレオチドに分解する一群の酵素の総称。DNase(ディーエヌアーゼ、またはディーエヌエース)とも呼ばれる。 末端から分解してゆくエキソヌクレオチダーゼと内部から分解してゆくエンドヌクレアーゼに大別されるほか、3'側のホスホジエステル結合を分解するものと5'側から分解するものに分けられる。前者にはデオキシリボヌクレアーゼI(DNアーゼI、EC 3.1.21.1)などが、後者にはデオキシリボヌクレアーゼII(DNアーゼII, EC 3.1.22.1)などがある。また、特異な例として2本鎖DNAは分解しないが1本鎖DNAを分解するものも存在する。殆どあらゆる生物に存在し、DNAの代謝等に関わっている。 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
デサチュラーゼデサチュラーゼ(desaturase)は、炭化水素鎖から2個の水素原子を除去する酵素で、炭素-炭素二重結合を生成する。不飽和化酵素とも。デサチュラーゼは以下のように分類される。
必須脂肪酸の生合成では、エロンガーゼがいくつかの異なるデサチュラーゼとともに繰り返しエチル基を挿入し、二重結合を形成していく。 ヒトの代謝での役割ヒトにはΔ9デサチュラーゼ、Δ6デサチュラーゼ、Δ5デサチュラーゼ、の3種が存在する。Δ6とΔ5デサチュラーゼ生産のための遺伝コードは11番染色体に位置している。 オレイン酸の合成ステアロイルCoA 9-デサチュラーゼとして知られるΔ9デサチュラーゼは、人体の全細胞の至る所に存在し、一価不飽和のオレイン酸の合成に使われる。Δ9デサチュラーゼは、体内でパルミチン酸から合成されたか外部から直接摂取されたステアリン酸を不飽和化することによってオレイン酸を合成する。融点69.9℃のステアリン酸が融点16.3℃のオレイン酸に変換されることにより、体温下での脂肪酸又は脂肪としての液体の性状を保つ。 リノール酸からアラキドン酸の合成Δ6デサチュラーゼは、リノレオイルCoAデサチュラーゼとも呼ばれ、必須脂肪酸である18:2(n-6)のリノール酸のΔ6の位置に不飽和結合を作ることにより18:3(n-6)のγ-リノレン酸を合成する。γ-リノレン酸は炭素2個分伸張されて20:3(n-6)のジホモ-γ-リノレン酸を生成し、これがΔ5デサチュラーゼによりジホモ-γ-リノレン酸のΔ5の位置に不飽和結合を作ることにより20:4(n-6)のアラキドン酸を合成する[1][信頼性要検証]。 α-リノレン酸からドコサヘキサエン酸の合成Δ6デサチュラーゼは必須脂肪酸である18:3(n-3)のα-リノレン酸のΔ6の位置に不飽和結合を作り炭素2個伸張して20:4(n-3)エイコサテトラエン酸を合成する。エイコサテトラエン酸はΔ5デサチュラーゼにより20:5(n-3)エイコサペンタエン酸を合成する。エイコサペンタエン酸は22:6(n-3)ドコサヘキサエン酸(DHA)のような高度不飽和脂肪酸の合成に必要とされる。これは、エロンガーゼとデサチュラーゼによる連続的な反応を必要とする多段階過程である。 ヒトでは、DHAは食品から摂取される以外に、2つの経路によって代謝生産される[2]。どちらもエイコサペンタエン酸からであるが、中間生成物が異なる。 ひとつはエイコサペンタエン酸を原料とし、エロンガーゼによって2炭素増炭されドコサペンタエン酸22:5(n-3) がつくられた後、Δ4-デサチュラーゼによって水素が引き抜かれて生成する過程である。 もうひとつの経路は、ペルオキシソームあるいはミトコンドリア中で進行すると考えられているもので、エイコサペンタエン酸が2回2炭素増炭されて24:5(n-3)となった後、Δ6デサチュラーゼにより不飽和化されて24:6(n-3)となり、その後β酸化によって炭素2個分が切断され22:6(n-3)のDHAが生成する。この経路は"Sprecher's shunt" として知られている。 植物の代謝での役割植物中で、オレイン酸から、ω6位に二重結合を作るΔ12-脂肪酸デサチュラーゼ によりオレイン酸の二重結合が一個増えてリノール酸が生成され、ついでω3位に二重結合を作るΔ15-脂肪酸デサチュラーゼ によりリノール酸の二重結合が一個増えてα-リノレン酸が生成される。動物の体内にはリノール酸もα-リノレン酸も作る酵素が存在しないので、これらの不飽和脂肪酸を必須脂肪酸として摂取しなければならない[3][信頼性要検証]。 その他のデサチュラーゼ酸化還元酵素#EC.1.14.19.-(2電子酸化により分子状酸素が還元され二分子の水になる)を参照のこと。 脚注
参考文献
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
セルロプラスミン
セルロプラスミン (ceruloplasminまたはcaeruloplasmin)は、公式にはフェロキシダーゼ (ferroxidase) または鉄(II):酸素-オキシドリダクターゼとして知られている。 血液中に見られる銅輸送タンパクであり、酵素である。(EC 1.16.3.1) 4 Fe2+ + 4 H+ + O2 4 Fe3+ + 2H2O 解説欠損症セルロプラスミンが欠損している場合、その原因として挙げられるものは:
過少症・欠乏症セルロプラスミンレベルが通常より低値である場合、その原因として挙げられるものは: 過多症・過剰症セルロプラスミンレベルが通常より高値である場合、その原因として挙げられるものは: 脚注1. ^ a b c GRCh38: Ensembl release 89: ENSG00000047457 - Ensembl, May 2017 2. ^ a b c GRCm38: Ensembl release 89: ENSMUSG00000003617 - Ensembl, May 2017 3. ^ "Human PubMed Reference:". 4. ^ "Mouse PubMed Reference:". 外部リンク関連項目 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
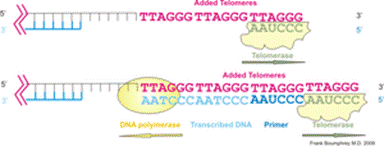
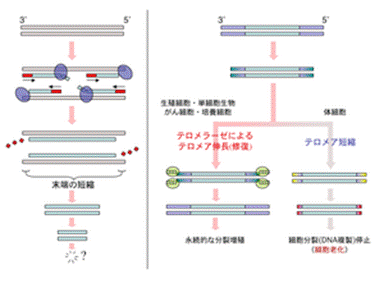
テロメラーゼテロメラーゼによるテロメア配列付加の模式図:上)ヒトのテロメラーゼは染色体末端DNAの 3'側に6塩基配列 TTAGGGを付加する。下)付加された配列をテンプレート(鋳型)としてDNAポリメラーゼが相補鎖を合成する。 末端複製問題とテロメア:左)DNAはDNAポリメラーゼ(青丸)によって複製されるが、最末端のプライマー(赤線)部分は複製されない。このため、複製のたびにDNAは短縮する。これが「末端複製問題」である。右)生殖細胞やガン細胞ではテロメラーゼによって末端部分の複製が行われる。テロメラーゼ活性がない体細胞では分裂ごとに短縮がおこり、一定以上短くなると分裂を停止し細胞老化が起こる。
テロメラーゼ (英: telomerase) は、真核生物の染色体末端(テロメア)の特異的反復配列を伸長させる酵素。テロメア伸長のテンプレート(鋳型)となるRNA構成要素と逆転写酵素活性を持つ触媒サブユニットおよびその他の制御サブユニットによって構成されている[1][2][3][4][5]。 テロメラーゼ活性が低い細胞は、一般に細胞分裂ごとにテロメアの短縮が進み、やがてヘイフリック限界と呼ばれる細胞分裂の停止が起きる[6][7][8]。テロメラーゼは、ヒトでは生殖細胞・幹細胞・ガン細胞などでの活性が認められ、それらの細胞が分裂を継続できる性質に関与している[1]。このことから、活性を抑制することによるガン治療、および活性を高めることによる細胞分裂寿命の延長、その両面から注目を浴びている。 酵素によりテロメアが伸長されることは、1973年にアレクセイ・オロヴニコフ (Alexey Olovnikov) によって最初に予測された[9]。彼はまた細胞老化に関するテロメア仮説およびガンとテロメアの関連について示唆を行った。 1985年にカリフォルニア大学のキャロル・W・グライダーとエリザベス・H・ブラックバーンは、テトラヒメナからこの酵素を単離したことを公表した[10]。グライダーとブラックバーンはジャック・W・ショスタクと共に、テロメアとテロメラーゼに関する一連の研究で[10][11][12]、2009年ノーベル生理学・医学賞を受賞した[13][14]。 概要構造と機能テロメラーゼはテロメア配列の鋳型となるRNAと逆転写酵素、その他の制御サブユニットからなる複合体である[1]。RNA構成要素はTERC (Telomere RNA Component, TRとも表記) 、逆転写酵素はTERT (Telomere Reverse Transcriptase) と呼ばれる。このRNAの長さはテトラヒメナで159塩基長、ヒトで451塩基長、出芽酵母で約1,300塩基長と様々である。逆転写酵素の活性部位はRNA型トランスポゾンがコードするそれと相同性がある。過剰発現の実験から、テロメラーゼ活性自体はRNAと逆転写酵素の二つの構成因子で十分であることがわかっているが[1]、テロメラーゼは生体内において巨大な複合体 (1MDa以上) を形成しており、正常な機能には他の構成サブユニットも必要である。 ヒトのテロメラーゼは、TERT[2]、TERC[3]、ジスケリン (dyskerin) [4]、TEP1[5]などのサブユニットによって構成されており、それらは異なる染色体上の遺伝子座にコードされている。TERT翻訳産物(タンパク質)は、非翻訳RNAであるTERCと一緒に折りたたまれる。TERTは一本鎖テロメア反復配列を付加できるように染色体の周囲を覆う二股の構造をとる。TERTとテロメアの鋳型を含むTERCは隣接している。ヒトTERCでは鋳型配列領域は 3'-CAAUCCCAAUC-5'であり、これを元にTERTはテロメアの3'側へ塩基を付加する(脊椎動物では6塩基配列5'-TTAGGG-3'(GGTTAG)を付加するが、他の生物では別の配列)[15]。テロメラーゼは、この塩基付加を繰り返し、染色体のテロメアの伸長を行う。 コクヌストモドキ (Tribolium castaneum) TERTのタンパク質構造の詳細な解析が、2008年に行われた[16]。このTERTは4つの保存されたドメイン(TRBD[17], fingers, palm, thumb)を含むタンパク質であり、レトロウイルスの逆転写酵素・ウイルスのRNAポリメラーゼ・バクテリオファージのDNAポリメラーゼ(ファミリーB)と共通の特徴を持つ環状構造をとっている。 テロメアおよびテロメラーゼの分子機構に関する実験には均一な細胞群を用いることが求められるため、主に出芽酵母やテトラヒメナといった単細胞生物、および哺乳類では培養細胞を用いて研究が行われている。テロメラーゼは細胞周期のS期(DNA合成期)にテロメアに誘導されて機能する。出芽酵母の研究では、テロメラーゼは細胞内で最も短いテロメアから優先的に伸長させていくことがわかりつつあり、長すぎるテロメアには抑制的に働く機構が見いだされている。 活性テロメラーゼの活性については、生物・組織・細胞の種類によって異なることが知られている。真核単細胞生物は例外なくテロメラーゼ活性を持ち、真核多細胞生物では生殖細胞にはテロメラーゼ活性があるが体細胞での活性はさまざまである[1]。植物においては調べられたほとんどの体細胞でテロメラーゼ活性があり、このことが株分けなど栄養生殖でほぼ無限に増殖できる不死性を持つ一因になっていると考えられている。ヒトでは生殖細胞・幹細胞以外での活性がほとんど見られないが、同じ脊椎動物でも魚類・マウス・チンパンジーでは体細胞でのテロメラーゼ活性が観察されている[1]。 ヒトでのテロメラーゼ構成要素の発現をみると、RNA構成要素TERCは体細胞でも発現しており、酵素活性は触媒サブユニットTERTの発現で調節されている[18]。ヒト培養細胞でゲノム中のTERTを強制発現をさせることは困難であるが、人為的に別のプロモーターを付加したTERTを導入することにより細胞の不死化を行うことができる。ヒトのガン組織の多くではテロメラーゼが大量に存在しており、ガン細胞の不死化の原因の一つと考えられている[18](一部のガン組織はテロメラーゼ陰性[19])。また、生殖細胞は個体を超えて世代を継続させる一種の不死性を持つが、テロメラーゼが恒常的に発現していることがその一因となっている。 臨床関連ガンヒトのガン組織の多くではテロメラーゼの活性化がおきており、その観察される割合は肺ガンの80%から食道ガンの95%に及ぶ[20]。一方、テロメラーゼ活性の制限要因であるTERTの発現が見られない腫瘍も観察されており[21]、それらではALT(Alternative Lengthening of Telomeres)と呼ばれるテロメア長を維持する別の機構が見出されている[19][22]。 ヒトのガン細胞とテロメラーゼとの関係についての説明は以下のようなものである[23]。
このようにテロメラーゼ遺伝子自体がガン化の直接原因ではないが、ガン組織の形成増殖にとってテロメラーゼ活性化が必要である場合が多いため、テロメラーゼを標的とした抗ガン剤の開発が行われている[19][23]。その例として、ヒトTERC(hTR)を標的とするGRN163/GRN163L(ジェロン社)[24][25]、テロメア短縮を誘導するBIBR1532(ベーリンガーインゲルハイム社)[26]、テロメア構造の安定化に作用するテロメスタチン[27][28]などがある。 個体老化遺伝的な要因による早老症として、ヘリカーゼ遺伝子を原因とするウェルナー症候群・ブルーム症候群 (Bloom syndrome) 、DNA修復に関連するキナーゼ遺伝子ATMを原因とする毛細血管拡張性運動失調症、ゲノム損傷修復の関連遺伝子を原因とするナイミーヘン症候群 (Nijmegen breakage syndrome) などが知られている[29]。これら早老症患者の細胞では分裂寿命が短くなりテロメア短縮も早まる事例があるとする報告や[29]、さまざまな早老症がテロメア短縮と関連しているとする報告がある[30]。これら遺伝子群のDNA修復機能とテロメア長の維持との正確な関連は判明しておらず、個体老化(早老症)とテロメア短縮との関連について研究が進められている。 テロメラーゼを利用した療法が、ヒトの老化を回避して寿命を延長させることにも使われると考える医師もいる[31]。しかしながら、テロメラーゼの活性化には、細胞老化防止の可能性[32] と、正常細胞のガン化の一因となり個体寿命の短縮化をもたらす可能性があること[33]の両面が指摘されており、アンチエイジングへの応用についての評価は定まっていない。 他のヒトの疾患テロメラーゼおよびその触媒サブユニットTERTは、ガン・早老症以外の疾患との関係も調べられている。 TERTと関係すると考えられている疾患としては、再生不良性貧血[34]、猫鳴き症候群 (Cri du chat Syndrome,CdCS) がある。CdCSは、5番染色体短腕(5p)の末端部分の欠損を含んでいる複雑な障害である。TERTは5p領域(染色体上の位置 5p15)にあり、TERTの欠損はCdCSの原因または関与要因として示唆されてきた[35]。 先天性角化異常症 (dyskeratosis congenita, DCまたはDKC) は、テロメラーゼ活性と関連する骨髄の疾患である[36]。症例の35%はX染色体連鎖(伴性遺伝)の劣性遺伝子疾患であり、5%は常染色体性の優性遺伝子疾患、残り60%は原因不明である[37][38]。X連鎖劣性の場合はジスケリン[39](染色体上の位置 Xq28)、常染色体性優性の場合はTERC[40](染色体上の位置 3q26.2)またはTERT[41]の変異が原因となっている。DC患者は、いろいろな他の徴候だけでなく、異常な網状皮膚色素沈着、白板症(口腔粘膜の白い肥厚)と爪の発育異常として現れるひどい骨髄不全を示す。X連鎖または常染色体性どちらのDC患者でも、同じ年齢のほかの人よりも短いテロメアと欠陥のあるテロメラーゼ活性を示す[38][42]。常染色体優性DCの患者家系の一つでは、世代が進むにつれ、テロメア短縮の率の増加および発症する年齢の低下現象(表現促進)、すなわち各々の世代での悪化が見られる例も存在する[43]。 引用文献1. ^ a b c d e f 井出(2006), pp. 1103-4. 6. ^ Hayflick L, Moorhead PS (1961). “The serial cultivation of human diploid cell strains”. Exp Cell Res 25: 585-621. PMID 13905659. 7. ^ 東京都老人総合研究所「ヒト胎児肺線維芽細胞(ヘイフリックモデル)」 8. ^ GEヘルスケア・ジャパン株式会社「バイオダイレクトメール vol.40 細胞夜話WI細胞〜Hayflick Limit発見の立役者」 9. ^ Olovnikov AM (1973). “A theory of marginotomy. The incomplete copying of template margin in enzymic synthesis of polynucleotides and biological significance of the phenomenon”. J Theor Biol. 41 (1): 181-90. PMID 4754905. 10. ^ a b Greider CW Blackburn EH (1985). “Identification of a specific telomere terminal transferase activity in Tetrahymena extracts”. Cell 43 (2 Pt 1): 405–13. PMID 3907856. 11. ^ Szostak JW, Blackburn EH (1982). “Cloning yeast telomeres on linear plasmid vectors”. Cell 29 (1): 245-55. PMID 6286143. 12. ^ Greider CW, Blackburn EH (1989). “A telomeric sequence in the RNA of Tetrahymena telomerase required for telomere repeat synthesis”. Nature 337 (6205): 331-7. PMID 2463488. 13. ^ AFPBB News(2009年10月06日フランス通信社発信ニュース)「ノーベル医学賞、寿命をつかさどるテロメアとテロメラーゼ酵素とは?」 14. ^ The Nobel Prize in Physiology or Medicine 2009; The Telomere– Function and Synthesis(pdf) 15. ^ Gavory G, Farrow M, Balasubramanian S (2002). “Minimum length requirement of the alignment domain of human telomerase RNA to sustain catalytic activity in vitro”. Nucleic Acids Res. 30 (20): 4470-80. PMID 12384594. 16. ^ Gillis AJ, Schuller A, Skordalakes E (2008), “Structure of the Tribolium castaneum telomerase catalytic subunit TERT”, Nature 455 (7213): 633–7, PMID 18758444 17. ^ Rouda S, Skordalakes E. (2007), “Structure of the RNA-binding domain of telomerase: implications for RNA recognition and binding”, Structure 15 (11): 1403-12, PMID 17997966 18. ^ a b 井出(2006), pp. 1105-9. 19. ^ a b c 井出(2006), p. 1110. 20. ^ 井出(2006), p. 1109.(fig.30). 21. ^ Bryan TM, Englezou A, Gupta J, Bacchetti S, Reddel RR. (1995). "Telomere elongation in immortal human cells without detectable telomerase activity." EMBO J. 14(17):4240-8. PMID 7556065 22. ^ Henson JD, Neumann AA, Yeager TR, Reddel RR (2002). “Alternative lengthening of telomeres in mammalian cells”. Oncogene 21 (4): 598-610. PMID 11850785. 23. ^ a b 清宮(2006), pp. 26-30. 24. ^ Asai A, Oshima Y, Yamamoto Y et al. (2003). “A novel telomerase template antagonist (GRN163) as a potential anticancer agent”. Cancer Res 63 (14): 3931-9. PMID 12873987. 25. ^ Dikmen ZG, Gellert GC, Jackson S et al. (2005). “In vivo inhibition of lung cancer by GRN163L: a novel human telomerase inhibitor”. Cancer Res 65 (17): 7866-73. PMID 16140956. 26. ^ Damm K, Hemmann U, Garin-Chesa P et al. (2001). “A highly selective telomerase inhibitor limiting human cancer cell proliferation”. EMBO J. 20 (24): 6958-68. PMID 11742973. 27. ^ Shin-ya K, Wierzba K, Matsuo K et al. (2001). “Telomestatin, a novel telomerase inhibitor from Streptomyces anulatus”. J Am Chem Soc. 123 (6): 1262-3. PMID 11456694. 28. ^ Tauchi T, Shin-ya K, Sashida G et al. (2006). “Telomerase inhibition with a novel G-quadruplex-interactive agent, telomestatin: in vitro and in vivo studies in acute leukemia”. Oncogene 25 (42): 5719-25. PMID 16652154. 30. ^ Blasco MA. "Telomeres and human disease: aging, cancer, and beyond." Nat Rev Genet. 2005 Aug; 6(8):611-22. PMID 16136653 31. ^ Fossel M (1998 Jun 3). “Telomerase and the aging cell: implications for human health”. JAMA 279 (21): 1732-5. PMID 9624027. 32. ^ Tomás-Loba A, Flores I, Fernández-Marcos PJ, Cayuela ML, Maraver A, Tejera A, Borrás C, Matheu A, Klatt P, Flores JM, Viña J, Serrano M, Blasco MA. "Telomerase reverse transcriptase delays aging in cancer-resistant mice." Cell. 2008 Nov 14;135(4):609-22 PMID 19013273 33. ^ de Magalhaes JP, Toussain O. "Telomeres and telomerase: a modern fountain of youth?" Rejuvenation Res. 2004 Summer; 7(2):126-33 PMID 15312299 34. ^ Yamaguchi H, Calado RT, Ly H et al. (2005). “Mutations in TERT, the gene for telomerase reverse transcriptase, in aplastic anemia”. New England Journal of Medicine 352 (14): 1413–24. PMID 15814878. 35. ^ Zhang A, Zheng C, Hou M et al. (2003). “Deletion of the telomerase reverse transcriptase gene and haploinsufficiency of telomere maintenance in Cri du chat syndrome”. Am J Hum Genet. 72 (4): 940–8. PMID 12629597. 36. ^ Yamaguchi(2007), pp. 202-9. 37. ^ Yamaguchi(2007), p. 202. 38. ^ a b Marrone A, Walne A, Dokal I (2005). “Dyskeratosis congenita: telomerase, telomeres and anticipation”. Curr Opin Genet Dev. 15 (3): 249–57. PMID 15917199. 39. ^ Heiss NS, Knight SW, Vulliamy TJ et al. (1998). “X-linked dyskeratosis congenita is caused by mutations in a highly conserved gene with putative nucleolar functions”. Nat Genet. 19 (1): 32-8. PMID 9590285. 40. ^ Vulliamy T, Marrone A, Goldman F et al. (2001). “The RNA component of telomerase is mutated in autosomal dominant dyskeratosis congenita”. Nature 413 (6854): 432-5. PMID 11574891. 41. ^ Vulliamy TJ, Walne A, Baskaradas A et al. (2005). “Mutations in the reverse transcriptase component of telomerase (TERT) in patients with bone marrow failure”. Blood Cells Mol Dis. 34 (3): 257-63. PMID 15885610. 42. ^ Vulliamy TJ, Knight SW, Mason PJ, Dokal I (2001). “Very short telomeres in the peripheral blood of patients with X-linked and autosomal dyskeratosis congenita”. Blood Cells Mol Dis. 27 (2): 353–7. PMID 11259155. 43. ^ Armanios M, Chen JL, Chang YP et al. (2005). “Haploinsufficiency of telomerase reverse transcriptase leads to anticipation in autosomal dominant dyskeratosis congenita”. PNAS 102 (44): 15960–4. doi:10.1073/pnas.0508124102. PMID 16247010. 参考文献
関連項目外部リンク
「https://ja.wikipedia.org/w/index.php?title=テロメラーゼ&oldid=65186582」から取得 カテゴリ: |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
と トリプトファニルアミノペプチダーゼ
トリプトファニルアミノペプチダーゼ(Tryptophanyl aminopeptidase、EC 3.4.11.17)は酵素である[1]。以下の化学反応 を触媒する。 N末端のトリプトファンを選択的に遊離する。 トリコスポロン属のTrichosporon cutaneum 由来のこの酵素は、L-トリプトファンアミドに対しても作用する。 出典1. ^ Iwayama, A., Kimura, T., Adachi, O. and Ameyama, M. (1983). “Crystallization and characterization of a novel aminopeptidase from Trichosporon cutaneum”. Agric. Biol. Chem. 47: 2483-2493. doi:10.1271/bbb1961.47.2483. 外部リンク
<img src="//ja.wikipedia.org/wiki/Special:CentralAutoLogin/start?type=1x1" alt="" title="" width="1" height="1" style="border: none; position: absolute;" /> 「https://ja.wikipedia.org/w/index.php?title=トリプトファニルアミノペプチダーゼ&oldid=58757470」から取得 カテゴリ: |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||